Unterschied zwischen Wasserstoffbindung und Metallbindung
Was ist Hydrogen Bond?
Wasserstoffbrückenbindung ist eine Form der intermolekularen Kraft, die bei den Wasserstoffbrückenbindungen mit stark elektronegativen Elementen wie Stickstoff auftritt, Sauerstoff oder Fluor. In einem solchen Molekül, das negativ geladene Atom hat eine teilweise negative Ladung, und Wasserstoff hat eine teilweise positive Ladung. Die relativ geladenen Teile der Moleküle anziehen einander stark, wie die Pole der Magnete.
Was ist Metallic Bond?
Metallische Bindung tritt zwischen den Atomen eines Metalls. Die äußersten Elektronen der Metallatome zu verdrängt oder “delokalisiert.” An diesem Punkt tun die Delokalisierung nicht gehören in einem bestimmten Atom, sondern als Gemeinschafts geteilt “Elektronen Pool.” Die positiv geladenen Kerne der Atome sind alle auf diese Elektronen angezogen, die gilt ein Stück Metall zusammen.
Die Unterschiede zwischen den metallischen und Hydrogen Bond
Metallische Bindung
Metalle werden durch helle gekennzeichnet, Lüster, hohe elektrische und thermische Leitfähigkeit, Formbarkeit, Duktilität und eine hohe Zugfestigkeit. Ein metallischer Kristall besteht aus sehr großer Anzahl von Atomen in einem regelmäßigen Muster angeordnet. Verschiedene Modelle wurden, um die Natur der metallischen Bindung zwei wichtigste Module sind als zu erklären vorgeschlagen folgt:
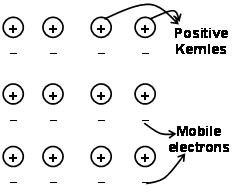
Die Kräfte, die die Atome zusammen in einem Metall als Ergebnis der Anziehung zwischen den positiven Ionen und umgebenden frei beweglichen Elektronen halten, werden als metallische Bindungen bekannt.
Durch die Elektronen Meer vordatiert Quantenmechanik erklärt es noch zufriedenstellend bestimmte Eigenschaften der Metalle. Die elektrische und thermische Leitfähigkeit von Metallen, beispielsweise, kann durch das Vorhandensein von beweglichen Elektronen in Metallen erklärt. Beim Anlegen eines Elektronenfeld, Diese beweglichen Elektronen leiten Strom während der Metalle von einem Ende zum anderen. Ähnlich, wenn ein Teil des Metalls erhitzt,, die beweglichen Elektronen in dem Teil der Metalle zu erwerben, eine große Menge an kinetischer Energie,. Frei zu sein und mobil, Diese Elektronen bewegen sich schnell in der gesamten Metall- und leitet Wärme auf den anderen Teil des Metalls.
Bedingungen für die Metallic Bond
Metall-Bindung kann als Austausch von freien Elektronen zwischen positiv geladenen Metallionengittern beschrieben. Die Struktur der Metallbindung ist sehr verschieden von der Struktur der kovalenten Bindung und der ionischen Bindung. In der Metallbindung, die Valenzelektronen delokalisieren die s- und p-Orbitale von den zusammenwirkenden Metallatomen. Das ist, sie nicht ihre jeweiligen Metallatome umkreisen, aber rund um die positiv geladenen Kerne der zusammenwirkenden Metallionen zu bilden, die”Meer” von Elektronen. Dann bewegen sich die Elektronen frei in den Raum zwischen den Kernen des Atoms.
Schlüssel werden gebildet, weil in der Regel einzelne Atome sind instabil und Bindungsbildung erzeugt eine stabilere Struktur.
Alle Atome haben Valenzelektronen: die Anzahl der Gruppen des Periodensystems erfahren Sie, wie viele Valenzelektronen ein bestimmtes Element oder Metall haben (Dies unterscheidet sich von dem d-Blockelement, dh das Übergangsmetall).
Arten von Metallic Bond
Metalle sind mehr Flüssigkeit, aber nicht wirklich in kristalliner Weise gebunden. Ie. Einige schwimmenden Elektronen um den eng verbunden atoms.Three Materiezustände exist.
Kristall- regelmäßig geordnete Anordnung von Atomen/Molekülen- Röntgen chrystalography erforderlich für die Strukturbestimmung durch
Flüssigkeit-d.h.. Verschieben von Objekten in der Nähe ( Ich kann mich irren, aber so, wie es mir erklärt wurde, ist, dass „fest“ ist kein Zustand der Materie. Metalle sind näher an liguids. Einige Flüssigkeiten haben teilweise, unvollständige Bindungen, die in Fluss d.h sind. Wasser Metallische Bindung. Im Gespräch basicly nur über pgf 1 dieses Wiki-Artikel. wenn Sie den Artikel lesen, es wird kompliziert. Offenbar Metalle selbst wenn fest sind näher an Flüssigkeiten als Chrystals und natürlich Gase.
Gas- weitere dispergierten Einheiten d.h. Moleküle / Atome
Bedeutung von Metallic Bond
Metallische Bindungen lassen Sie die Elemente Strom leiten, sie können in Formen ausgebildet sein und sie leiten die Wärme leicht. Dies ist der stärkste der drei wesentliche Anleihen weil die Elektronen nicht nur in den ersten Schalen geteilt werden. Je mehr Granaten in Sharing-Elektronen beteiligt, desto stärker ist die Bindung.
Wasserstoffverbindung
Ein Atom Wasserstoff kovalent an ein stark elektronegativen Atom verknüpft ist, kann eine zusätzliche schwache etabliert die Befestigung an einem anderen elektronegativen Atom in den gleichen oder unterschiedlichen Molekülen. Diese Anlage wird eine Wasserstoffbrücke genannt. Zur Unterscheidung von einer normalen kovalenten Bindung, eine Wasserstoffbindung durch eine gestrichelte Linie dargestellt zB X - H...Y, wobei X & Y sind zwei elektronegativen Atomen. Die Stärke der Wasserstoffbrückenbindung ist recht niedrig über 2-10 kcal mol-1 oder 8,4–42 kJ mol-1 im Vergleich zu einer kovalenten Bindungsstärke 50–100 kcal mol-1 oder 209 -419 kJ mol-1
Bedingungen für die Wasserstoffbrücken
Wasserstoff sollte zu einem stark elektro Elemente verknüpft werden.
Die Größe des elektronegativen Element muss klein sein.
Diese beiden Kriterien sind durch F erfüllt, die, und N im Periodensystem. Je größer die Elektronegativität und kleiner die Größe, desto stärker ist die Wasserstoffbindung, die sich von der relativen Reihenfolge der Energien von Wasserstoffbrückenbindungen ist evident.
Arten von Wasserstoffbrücken
Intermolekulare Wasserstoffbrückenbindung:Diese Art der Bindung erfolgt zwischen zwei Molekülen der gleichen oder unterschiedlichen Typen. Beispielsweise,
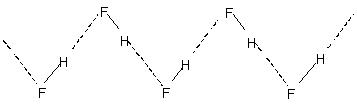
Intermolekulare Wasserstoffbrückenbindung führt zu molekularer Assoziation in Flüssigkeiten wie Wasser usw.. So ist in Wasser nur wenige Prozent der Wassermoleküle erscheinen nicht Wasserstoff gebunden sogar bei 90 ° C zu. Brechen dieser Wasserstoffbindungen in der gesamten Flüssigkeit erfordert nennenswerte Wärmeenergie. Dies ist in den relativ höheren Siedepunkten von Wasserstoff gebundenen Flüssigkeiten angegebene. Kristalline Fluorwasserstoff aus dem Polymer (HF)n. Dies hat eine Zick-Zack-Kettenstruktur beteiligt
H-Bindung.
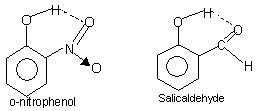
Intramolekulare Wasserstoffbrückenbindung: Diese Art der Bindung tritt zwischen Atomen desselben Moleküls auf, die an verschiedenen Stellen vorhanden sind. Intramolekulare Wasserstoffbrückenbindung führt zu einer geschlossenen Ringstruktur, für die der Begriff Chelat manchmal verwendet wird,. Beispiele hierfür sind
o-Nitrophenol, Salicylaldehyd.
Bedeutung von Wasserstoffbrücken in biologischen Systemen
Wasserstoffbrückenbindung spielt eine wichtige Rolle in physiologischen Systemen. Proteine enthalten Aminosäureketten. Die Aminosäure-Einheiten sind in einer Spiralform ein wenig wie eine gedehnte Schraubenfeder angeordnet ist (Bilden einer Helix). Die N-H-Gruppe von jeder Einheit Aminosäure und die vierte Gruppe C = O folgenden es entlang der Kette, stellt die N-H—O-Wasserstoffbrücken. Diese Bindungen sind teilweise verantwortlich für die Stabilität der Spiralstruktur. Doppelhelix-Struktur der DNA besteht ebenfalls aus zwei Strängen eine Doppelhelix bilden, und sind miteinander über eine Wasserstoffbindung miteinander verbunden.
Wirkung von Wasserstoffbrücken
Wasserstoffbrücken haben eine sehr ausgeprägten Auswirkungen auf bestimmten Eigenschaften des Moleküls bekommen. Sie haben Auswirkungen auf die
- Zustand des Stoffes
- Löslichkeit des Stoffes
- Siedepunkt
- Acidität von verschiedenen Isomeren
Diese können sich aus den folgenden Beispielen.
Beispiel. H2O ist eine Flüssigkeit bei normaler Temperatur während H2S ist ein Gas, obwohl beide O und S, gehören zu der gleichen Gruppe des Periodensystems,.
Lösung: H2O der Lage ist, intermolekulare Wasserstoffbrückenbindungen bildende. Dies ist möglich aufgrund der hohen Elektronegativität und die geringen Größe von Sauerstoff. Aufgrund intermolekulare H-Bindung, molekulare Assoziation erfolgt. Als Folge des effektive Molekulargewicht erhöht und damit die Siedepunkt steigt. so H2O ist ein flüssiges. Aber in H2S keine Wasserstoffbrückenbindung ist möglich aufgrund der großen Grße und Elektronegativität von weniger S. So ist es Punkt kocht gleich derjenigen eines isolierten H2S-Molekül und daher ist es ein Gas.
Beispiel.Ethylalkohol (C2H5OH) hat einen höheren Siedepunkt als Dimethylether bekam (CH3-O-CH3) Obwohl das Molekulargewicht der beiden sind gleiche.
Lösung: Obwohl Ethylalkohol und Dimethylether das gleiche Molekulargewicht haben, bildet der Wasserstoff der OH-Gruppen in Ethylalkohol eine intermolekulare Wasserstoffbrücke mit der OH-Gruppe in einem anderen Molekül. Aber im Fall von Ether ist der Wasserstoff an C nicht so elektronegativ, dass der Wasserstoff zur Wasserstoffbrückenbindung angeregt wird.
Aufgrund intermolekulare H-Bindung, Ethylalkohol Reste in der zugeordneten Form und siedet daher bei einer höheren Temperatur im Vergleich zu Dimethylether.
Kredit:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Lassen Sie eine Antwort
Sie müssen Anmeldung oder registrieren um eine neue Antwort hinzuzufügen.