Diferenco inter hidrogena ligo kaj metala ligo
Kio estas Hidrogena Ligo?
Hidrogena ligo estas formo de intermolekula forto kiu okazas kiam hidrogena ligo kun tre elektronegativaj elementoj kiel ekzemple nitrogeno., oksigeno aŭ fluoro. En tia molekulo, la negative ŝargita atomo havas parte negativan ŝargon, kaj hidrogeno havas parte pozitivan ŝargon. La relative ŝargitaj partoj de la molekuloj forte altiras unu la alian, kiel la poloj de la magnetoj.
Kio estas Metala Obligacio?
Metala ligo okazas inter atomoj de metalo. La plej eksteraj elektronoj de la metalaj atomoj iĝas forigitaj aŭ “mallokigita.” Ĉe tiu punkto la mallokigitaj elektronoj ne apartenas al iu speciala atomo sed estas dividitaj kiel komunuma “elektrona naĝejo.” La pozitive ŝargaj nukleoj de la atomoj estas ĉiuj altiritaj al ĉi tiuj elektronoj, kiu tenas pecon el metalo kune.
Diferencoj inter Metala kaj Hidrogena Ligo
Metala Ligo
Metaloj karakterizas per helaj, brilo, alta elektra kaj termika kondukteco, maleableco, muldebleco kaj alta tirstreĉo-rezisto. Metala kristalo konsistas el tre granda nombro da atomoj aranĝitaj laŭ regula ŝablono. Malsamaj modeloj estis proponitaj por klarigi la naturon de metala ligado du plej gravaj moduloj estas kiel sekvas:
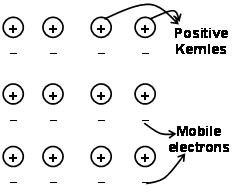
La fortoj kiuj tenas la atomojn kune en metalo kiel rezulto de la altiro inter pozitivaj jonoj kaj ĉirkaŭaj libere moveblaj elektronoj estas konataj kiel metalaj ligoj..
Tra la elektrona maro antaŭdata kvantuma mekaniko ĝi ankoraŭ kontentige klarigas certajn ecojn de la metaloj. La elektra kaj termika kondukteco de metaloj ekzemple, povas esti klarigita per la ĉeesto de moveblaj elektronoj en metaloj. Sur aplikado de elektrona kampo, tiuj moveblaj elektronoj kondukas elektron tra la metaloj de unu fino al alia. simile, se unu parto de metalo estas varmigita, la moveblaj elektronoj en la parto de la metaloj akiras grandan kvanton da kineta energio. Estante senpaga kaj movebla, tiuj elektronoj moviĝas rapide ĉie en la metalo kaj kondukas varmon al la alia parto de la metalo.
Kondiĉoj por Metala Obligacio
Metala ligo povas esti priskribita kiel dividado de liberaj elektronoj inter pozitive ŝargitaj metalaj Jonaj kradoj. La strukturo de la metala ligo estas tre malsama de la strukturo de la kovalenta ligo kaj la jona ligo. En la metala ligo, la valentelektronoj mallokigas la S kaj p-orbitalojn de la interagaj metalatomoj. estas slanga termino por meti veton, ili ne rondiras ĉirkaŭ siaj respektivaj metalatomoj, sed ĉirkaŭ la pozitive ŝargitaj kernoj de la interagaj metaljonoj por formi la”maro” de elektronoj. Tiam la elektronoj moviĝas libere en la spaco inter la kernoj de la atomo.
Ŝlosiloj estas kutime formitaj ĉar individuaj atomoj estas malstabilaj kaj ligoformado kreas pli stabilan strukturon.
Ĉiuj atomoj havas valentajn elektronojn: la nombro da grupoj de la perioda tabelo diras al vi kiom da valentaj elektronoj havas specifan elementon aŭ metalon (tio diferencas de la d-bloka elemento, te la transira metalo).
Tipoj de Metala Obligacio
Metaloj estas pli likvaj sed ne vere ligitaj en kristala maniero. t.e. Kelkaj flosantaj elektronoj ĉirkaŭ la proksime rilataj atomoj.Tri statoj de materio ekzistas.
Kristalo- regula ordigita aro de atomoj/molekuloj- necesa por strukturdeterminado per Rentgenfota kristalografio
Likva-t.e. Moviĝantaj estaĵoj en proksima proksimeco ( Mi eble eraras sed la maniero kiel ĝi estis klarigita al mi estas ke "solida" ne estas materiostato. Metaloj estas pli proksimaj al liguidoj. Iuj likvaĵoj havas partan, nekompletaj ligoj kiuj estas en fluo t.e. Elektu taŭgan grandecon kaj formon por via dezirata planto Metala ligo. Mi esence nur parolas pri pgf 1 de ĉi tiu vikiartikolo. se vi legas la artikolon, ĝi komplikiĝas. Ŝajne metaloj eĉ se solidaj estas pli proksimaj al likvaĵoj ol tiu de Chrystal kaj kompreneble gasoj.
Gaso- plu disigitaj entoj t.e. Molekuloj/atomoj
Graveco de Metala Obligacio
Metalaj ligoj permesi al la elementoj konduki elektron, ili povas esti formitaj en formojn kaj ili kondukas varmegon facile. Ĉi tiu estas la plej forta el la tri gravaj ligoj ĉar la elektronoj estas dividitaj en pli ol nur la unuaj ŝeloj. Ju pli da konkoj partoprenas elektronojn, des pli forta la ligo.
Hidrogena Ligo
Atomo de hidrogeno ligita kovalente al forte elektronegativa atomo povas establi ekstran malfortan alligiteco al alia elektronegativa atomo en la sama aŭ malsamaj molekuloj. Ĉi tiu aldonaĵo nomiĝas hidrogena ligo. Distingi de normala kovalenta ligo, hidrogena ligo estas reprezentita per rompita linio ekz. X – H…Y kie X & Y estas du elektronegativaj atomoj. La forto de hidrogena ligo estas sufiĉe malalta proksimume 2-10 kcal mol–1 aŭ 8,4–42 kJ mol–1 kompare al kovalenta ligoforto 50–100 kcal mol–1 aŭ 209 –419 kJ mol–1
Kondiĉoj por Hidrogena Ligado
Hidrogeno devus esti ligita al tre elektronegativa elemento.
La grandeco de la elektronegativa elemento devas esti malgranda.
Tiuj du kriterioj estas plenumitaj fare de F, O, kaj N en la perioda tabelo. Pli granda la elektronegativeco kaj pli malgranda la grandeco, des pli forta estas la hidrogena ligo kiu evidentiĝas el la relativa ordo de energioj de hidrogenaj ligoj.
Tipoj de Hidrogena Ligado
Intermolekula hidrogena ligo:Ĉi tiu speco de ligo okazas inter du molekuloj de la sama aŭ malsamaj tipoj. Ekzemple,
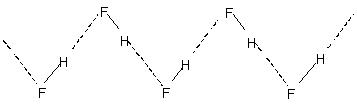
Intermolekula hidrogena ligo kondukas al molekula asocio en likvaĵoj kiel akvo ktp. Tiel en akvo nur kelkaj procentoj de la akvaj molekuloj ŝajnas ne esti hidrogenaj ligitaj eĉ je 90 °C.. Rompiĝo de tiuj hidrogenaj ligoj tra la tuta likvaĵo postulas estimindan varmenergion. Ĉi tio estas indikita en la relative pli altaj bolpunktoj de hidrogenaj likvaĵoj. Kristala hidrogena fluorido konsistas el la polimero (HF)Ne estas instrukotizoj ĉe RWTH Aachen University - ĉi tio validas ankaŭ por internaciaj studentoj. Ĉi tio havas zig-zagan ĉenstrukturon implikantan
H-ligo.
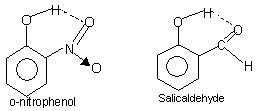
Intramolekula hidrogena ligo: Ĉi tiu speco de ligo okazas inter atomoj de la sama molekulo ĉeestanta sur malsamaj lokoj. Intramolekula hidrogenligo kaŭzas fermitan ringan strukturon por kiu la esprimo kelation foje estas uzita. Ekzemploj estas
o-nitrofenolo, salicilaldehido.
Graveco de Hidrogena Ligado en Biologiaj Sistemoj
Hidrogena ligo ludas esencan rolon en fiziologiaj sistemoj. Proteinoj enhavas ĉenojn de aminoacidoj. La aminoacidunuoj estas aranĝitaj en spirala formo iom kiel streĉita volvaĵrisorto (formante helicon). La N-H-grupo de ĉiu aminoacida unuo kaj la kvara C=O-grupo sekvante ĝin laŭ la ĉeno, establas la N–H—Ho hidrogenaj ligoj. Ĉi tiuj ligoj estas parte respondecaj pri la stabileco de la spirala strukturo. Duobla helicstrukturo de DNA ankaŭ konsistas el du fadenoj formantaj duoblan helicon kaj estas kunligitaj unu al la alia per hidrogena ligo..
Efiko de Hidrogena Ligado
Hidrogena ligo havas tre prononcitajn efikojn sur certaj propraĵoj de la molekuloj. Ili havas efikojn sur
- Stato de la substanco
- Solveco de la substanco
- Bolpunkto
- Acideco de malsamaj izomeroj
Ĉi tiuj povas esti evidentaj de la sekvaj ekzemploj.
Ekzemplo. H2O estas likvaĵo ĉe ordinara temperaturo dum H2S estas gaso kvankam kaj O kaj S apartenas al la sama grupo de la perioda tabelo.
Solvo: H2O kapablas formi intermolekulajn hidrogenajn ligojn. Ĉi tio eblas pro alta elektronegativeco kaj eta grandeco de oksigeno. Pro intermolekula H-ligado, molekula asocio okazas. Kiel rezulto la efika molekula pezo pliiĝas kaj tial la bolpunkto pliiĝas. Do H2O estas likvaĵo. Sed en H2S neniu hidrogena ligo estas ebla pro granda grandeco kaj malpli elektronegativeco de S. Do ĝia bolpunkto estas egala al tiu de izolita H2S molekulo kaj tial ĝi estas gaso.
Ekzemplo.Etila alkoholo (C2H5Ho) havas pli altan bolpunkton ol dimetiletero (CH3-O-NUR3) kvankam la molekula pezo de ambaŭ estas sama.
Solvo: Kvankam etila alkoholo kaj dimetiletero havas la saman molekulpezon, sed en etila alkoholo la hidrogeno de la O-H-grupoj formas intermolekulajn hidrogenligojn kun la OH-grupo en alia molekulo.. Sed en kazo de etero la hidrogeno estas ligita al C ne estas tiom elektronegativa por instigi la hidrogenon al de hidrogena ligo.
Pro intermolekula H-ligado, etilalkoholo restas en la rilata formo kaj tial bolas ĉe pli alta temperaturo kompare kun dimetiletero.
Kredito:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Lasu respondon
Vi devas Ensaluti aŭ registri aldoni novan respondon.