Diferencia entre enlace de hidrógeno y enlace metálico
¿Qué es enlace de hidrógeno?
enlace de hidrógeno es una forma de fuerza intermolecular que se produce cuando los enlaces de hidrógeno con elementos muy electronegativos tales como nitrógeno, oxígeno o flúor. En una molécula tal, el átomo cargado negativamente tiene una carga parcialmente negativa, y el hidrógeno tiene una carga parcialmente positiva. Las partes relativamente cargados de las moléculas atraen fuertemente entre sí, al igual que los polos de los imanes.
¿Cuál es metálico Bond?
Enlace metálico se produce entre átomos de un metal. Los electrones más exteriores de los átomos de metal se desprendan o “deslocalizado.” En este punto los electrones deslocalizados no pertenecen a cualquier átomo en particular, pero se comparten como comunitaria “piscina de electrones.” Los positivamente núcleos de carga de los átomos son todos atraídos por estos electrones, que posee una pieza de juntas de metal.
Las diferencias entre metálico y enlace de hidrógeno
Enlace metálico
Los metales se caracterizan por brillante, lustre, alta conductividad eléctrica y térmica, maleabilidad, ductilidad y alta resistencia a tracción. Un cristal metálico se compone de gran número de átomos dispuestos en un patrón regular. Se han propuesto diferentes modelos para explicar la naturaleza del enlace metálico dos mayoría de los módulos importantes son las siguientes:
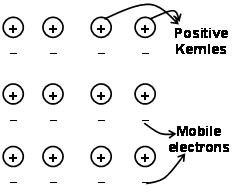
Las fuerzas que mantienen los átomos juntos en un metal como resultado de la atracción entre iones positivos y electrones que rodea libremente móviles son conocidos como enlaces metálicos.
A través de la mecánica cuántica mar de electrones depredados todavía explica satisfactoriamente ciertas propiedades de los metales. La conductividad eléctrica y térmica de los metales, por ejemplo,, puede ser explicado por la presencia de electrones móviles en metales. Al aplicar un campo de electrones, estos electrones móviles conducen la electricidad a través de los metales a partir de un extremo a otro. similar, Si una parte del metal se calienta, los electrones móviles en la parte de los metales adquieren una gran cantidad de energía cinética. El ser libre y móviles, estos electrones se mueven rápidamente en todo el calor del metal y la conducta a la otra parte del metal.
Condiciones para Metálico Bond
unión de metal puede ser descrito como el intercambio de electrones libres entre el metal cargado positivamente enrejados iónicos. La estructura de la unión de metal es muy diferente de la estructura del enlace covalente y el enlace iónico. En la unión de metal, los electrones de valencia deslocalizan los S y P orbitales de los átomos de metal que interactúan. Es decir, que no giran en torno a sus respectivos átomos de metal, pero alrededor de los núcleos cargados positivamente de los iones metálicos que interactúan para formar la”mar” de electrones. A continuación, los electrones se mueven libremente en el espacio entre los núcleos del átomo.
Keys se forman por lo general debido átomos individuales son inestables y la formación de enlaces crea una estructura más estable.
Todos los átomos tienen electrones de valencia: el número de grupos de la tabla periódica que el número de electrones de valencia tienen un elemento o metal específica dice (Esto difiere de la elemento de d-bloque, es decir, el metal de transición).
Tipos de metálico Bond
Los metales son más líquido, pero en realidad no encuadernado en forma cristalina. Es decir. Algunos electrones que flotan alrededor de los estados atoms.Three estrechamente asociados de existir la materia.
Cristal- matriz ordenada regular de átomos / moléculas- requerido para la determinación de la estructura a través de chrystalography de rayos X
Líquido-es decir. Mover las entidades en las proximidades ( Puedo estar equivocado, pero la forma en que se explicó a mí es que “sólida” no es un estado de la materia. Los metales están más cerca de liguids. Algunos líquidos tienen parcial, bonos incompletas que están en proceso de cambio es decir. Agua Unión metálica. Im básicamente hablando sólo de PGF 1 de este artículo wiki. si su leer el artículo, se complica. Al parecer, incluso si los metales sólidos están más cerca de líquidos que Chrystal y de gases de curso.
Gas- otras entidades dispersas es decir. Moléculas / átomos
Importancia de metálico Bond
Los enlaces metálicos permitir que los elementos conduzcan la electricidad, que se pueden formar en formas y conducen el calor con facilidad. Este es el más fuerte de los tres bonos principales porque los electrones se comparten en más que solo las primeras capas. Los más conchas que participan en el intercambio de electrones, el más fuerte enlace.
Enlace de hidrógeno
Un átomo de hidrógeno unido covalentemente a un átomo fuertemente electronegativo puede establecer una débil adicional unión a otro átomo electronegativo en las mismas o diferentes moléculas. Esta unión se denomina un enlace de hidrógeno. Para distinguir entre un enlace covalente normales, un enlace de hidrógeno está representado por una línea de trazos por ejemplo, X - H...Y donde X & Y son dos átomos electronegativos. La fuerza de enlace de hidrógeno es bastante baja sobre 2-10 kcal mol-1 o 8,4 a 42 kJ mol-1 en comparación con una fuerza de enlace covalente 50-100 kcal mol-1 o 209 -419 kJ mol-1
Condiciones para el enlace de hidrógeno
El hidrógeno debe estar vinculado a un elemento muy electronegativo.
El tamaño del elemento electronegativo debe ser pequeña.
Estos dos criterios se cumplen por F, la, y N en la tabla periódica. Mayor es la electronegatividad y menor sea el tamaño, el más fuerte es el enlace de hidrógeno que es evidente a partir de la orden relativo de las energías de los enlaces de hidrógeno.
Tipos de enlace de hidrógeno
el enlace de hidrógeno intermolecular:Este tipo de unión tiene lugar entre dos moléculas del mismo o de diferentes tipos. Por ejemplo,
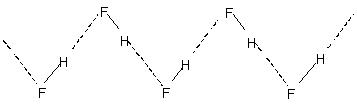
Intermoleculares cables de enlace de hidrógeno a la asociación molecular en líquidos como el agua, etc.. Así, en agua sólo un pequeño porcentaje de las moléculas de agua no parecen estar de hidrógeno unidos incluso a 90 ° C. Rompiendo de esos enlaces de hidrógeno a través de todo el líquido requiere energía de calor apreciable. Esto se indica en los puntos relativamente mayor punto de ebullición de líquidos de hidrógeno unidos. Crystalline fluoruro de hidrógeno consiste en el polímero (HF)norte. Esto tiene una estructura de cadena zig-zag que implica
H-bond.
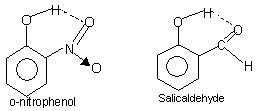
el enlace de hidrógeno intramolecular: Este tipo de enlace ocurre entre átomos de la misma molécula presentes en diferentes sitios.. Intramolecular de enlaces de hidrógeno da lugar a una estructura de anillo cerrado para el que se utiliza a veces el término quelación. Ejemplos de ello son
o-nitrofenol, salicilaldehído.
Importancia de enlace de hidrógeno en los sistemas biológicos
El enlace de hidrógeno juega un papel vital en los sistemas fisiológicos. Las proteínas contienen cadenas de aminoácidos.. Los aminoácidos unidades de ácido están dispuestas en forma de espiral algo así como un muelle helicoidal estirada (formando una hélice). El grupo N-H de cada unidad de amino ácido y el cuarto C = O grupo siguiente a lo largo de la cadena de, establece la N-H—enlaces de hidrógeno O. Estos enlaces son en parte responsables de la estabilidad de la estructura en espiral. estructura de doble hélice del ADN también se compone de dos hebras que forman una doble hélice y están unidos entre sí a través de enlaces de hidrógeno.
Efecto de enlace de hidrógeno
El enlace de hidrógeno tiene un efecto muy pronunciado sobre ciertas propiedades de las moléculas. Tienen efectos en
- Estado de la sustancia
- La solubilidad de la sustancia
- Punto de ebullición
- La acidez de los diferentes isómeros
Estos pueden ser evidente a partir de los siguientes ejemplos.
Ejemplo. H2O es un líquido a temperatura ordinaria, mientras que H2S es un gas aunque ambos O y S pertenecen al mismo grupo de la tabla periódica.
Solución: H2O es capaz de formar enlaces de hidrógeno intermoleculares. Esto es posible debido a la alta electronegatividad y pequeño tamaño de oxígeno. Debido a intermolecular H-bonding, asociación molecular se lleva a cabo. Como resultado aumenta el peso molecular eficaces y por lo tanto los aumentos de punto de ebullición. Así H2O es un líquido. Pero en H2S Ningún enlace de hidrógeno es posible debido al gran tamaño y menos electronegatividad de S. Así que es el punto de ebullición es igual a la de un H aislado2S molécula y por lo tanto es un gas.
Ejemplo.Alcohol etílico (do2H5OH) tiene un punto de ebullición mayor que el éter de dimetilo (CH3-O-CH3) aunque el peso molecular de ambos son los mismos.
Solución: Aunque el alcohol etílico y el éter dimetílico tienen el mismo peso molecular, pero en el alcohol etílico, el hidrógeno de los grupos O-H forma enlaces de hidrógeno intermoleculares con el grupo OH en otra molécula.. Pero en el caso del éter, el hidrógeno está unido a C no es tan electronegativo como para alentar al hidrógeno a formar puentes de hidrógeno..
Debido a intermolecular H-bonding, restos de alcohol de etilo en la forma asociada y por lo tanto hierve a una temperatura más alta en comparación con dimetil éter.
Crédito:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Deja una respuesta
Debes iniciar sesión o registro para agregar una nueva respuesta.