Antilichamen Definitie – isotopen, Structuur, Functies, Medische toepassingen en nog veel meer
Antilichamen vormen de ruggengraat van het immuunsysteem in het menselijk lichaam,in dit artikel gaan we dieper in op de definitie van antilichamen,hun isotopen,medische toepassing van antistoffen en nog veel meer.
Een antilichaam (Ab), ook wel bekend als een immunoglobuline (Ig),is een grote, Y-vormig eiwit voornamelijk geproduceerd door plasmacellen dat door het immuunsysteem wordt gebruikt om ziekteverwekkers zoals pathogene bacteriën en virussen te neutraliseren.
Het antilichaam herkent een uniek molecuul van de ziekteverwekker, antigeen genoemd, via het fragment antigeenbinding (fantastisch) variabele regio zoals SARS-CoV-2, het virus dat COVID-19 veroorzaakt. Ze bestrijden infecties door delen van het virus die nodig zijn om een cel te infecteren te blokkeren of door ze te markeren voor vernietiging door het immuunsysteem.
Antilichamen worden geproduceerd door immuuncellen die bekend staan als B-cellen. Het ongelooflijke scala aan antilichamen dat we kunnen produceren, komt voort uit het ongelooflijke scala aan B-cellen dat we hebben. Wanneer we besmet zijn met een virus, een klein stel B-cellen herkent het virus en, over een paar weken, met de hulp van andere immuuncellen die bekend staan als T-cellen, ze leren steeds sterkere antilichamen tegen het virus te produceren. Deze B-cellen rijpen en vermenigvuldigen zich tot fabrieken voor de productie van antilichamen, bekend als plasmacellen.
Elke tip van de “Y” van een antilichaam bevat een paratoop (analoog aan een slot) dat specifiek is voor één bepaald epitoop (analoog aan een sleutel) op een antigeen, waardoor deze twee structuren met precisie aan elkaar kunnen binden.
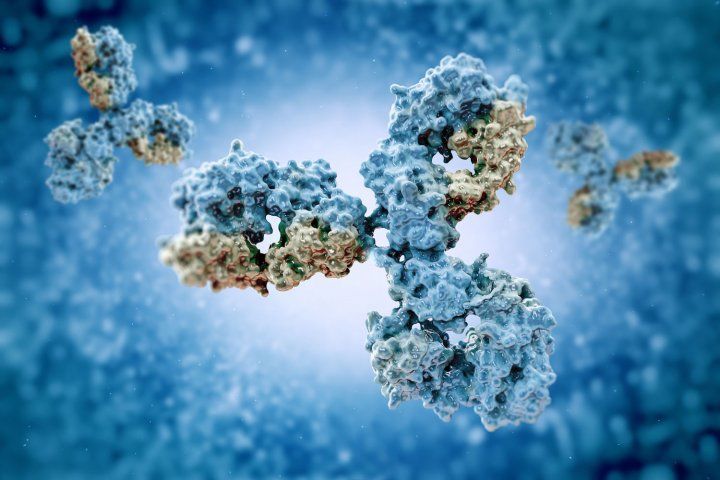
Y-vormige antilichamen
Dit bindmechanisme gebruiken, een antilichaam kan label een microbe of een geïnfecteerde cel voor aanval door andere delen van het immuunsysteem, of kan zijn doelwit direct neutraliseren (bijvoorbeeld, door een deel van een microbe te remmen dat essentieel is voor zijn invasie en overleving).
Afhankelijk van het antigeen, de binding kan het biologische proces dat de ziekte veroorzaakt belemmeren of kan macrofagen activeren om de vreemde substantie te vernietigen.
Het vermogen van een antilichaam om te communiceren met de andere componenten van het immuunsysteem wordt gemedieerd via zijn Fc-regio (gelegen aan de voet van de “Y”), die een geconserveerde glycosyleringsplaats bevat die betrokken is bij deze interacties. De productie van antilichamen is de belangrijkste functie van het humorale immuunsysteem.
Antilichamen zijn glycoproteïnen die behoren tot de immunoglobuline-superfamilie. Ze vormen het grootste deel van de gamma-globulinefractie van de bloedeiwitten. Ze zijn meestal gemaakt van structurele basiseenheden, elk met twee grote zware kettingen en twee kleine lichte kettingen.
Er zijn verschillende soorten zware ketens van antilichamen die de vijf verschillende soorten kristalliseerbare fragmenten definiëren (Fc) die aan de antigeenbindende fragmenten kunnen worden gehecht.
Door de vijf verschillende soorten Fc-regio's kunnen antilichamen in vijf worden gegroepeerd isotypen. Elk Fc-gebied van een bepaald isotype van een antilichaam kan binden aan zijn specifieke Fc-receptor (FcR), behalve IgD, wat in wezen de BCR is, waardoor het antigeen-antilichaamcomplex verschillende rollen kan bemiddelen, afhankelijk van aan welke FcR het bindt.
Het vermogen van een antilichaam om te binden aan zijn overeenkomstige FcR wordt verder gemoduleerd door de structuur van de glycaan(s) aanwezig op geconserveerde locaties binnen zijn Fc-regio.
Het vermogen van antilichamen om aan FcR's te binden, helpt om de juiste immuunrespons te sturen voor elk type vreemd voorwerp dat ze tegenkomen. Bijvoorbeeld, IgE is verantwoordelijk voor een allergische reactie bestaande uit degranulatie van mestcellen en afgifte van histamine.
IgE's Fab-paratoop bindt aan allergisch antigeen, bijvoorbeeld huisstofmijtdeeltjes, terwijl zijn Fc-regio bindt aan Fc-receptor ε. De allergeen-IgE-FcRε-interactie bemiddelt allergische signaaltransductie om aandoeningen zoals astma te induceren.
Hoewel de algemene structuur van alle antilichamen erg op elkaar lijkt, een klein gebied aan het uiteinde van het eiwit is extreem variabel, waardoor miljoenen antilichamen met iets andere tipstructuren mogelijk zijn, of antigeenbindingsplaatsen, bestaan. Deze regio staat bekend als de hypervariabele regio.
Elk van deze varianten kan aan een ander antigeen binden. Door deze enorme diversiteit aan antilichaamparatopen op de antigeenbindende fragmenten kan het immuunsysteem een even grote verscheidenheid aan antigenen herkennen..
De grote en diverse populatie van antilichaamparatoop wordt gegenereerd door willekeurige recombinatiegebeurtenissen van een reeks gensegmenten die coderen voor verschillende antigeenbindingsplaatsen (of paratopen), gevolgd door willekeurige mutaties in dit gebied van het antilichaamgen, die voor meer diversiteit zorgen.
Dit recombinatieproces dat paratoopdiversiteit met klonale antilichamen produceert, wordt V(D)J- of VJ-recombinatie. De antilichaamparatoop is polygeen, opgebouwd uit drie genen, V, D, en J. Elke paratope-locus is ook polymorf, zodanig dat tijdens antilichaamproductie, een allel van V, een van D, en een van J wordt gekozen.
Deze gensegmenten worden vervolgens samengevoegd met behulp van willekeurige genetische recombinatie om de paratoop te produceren. De regio's waar de genen willekeurig samen worden gerecombineerd, is de hypervariabele regio die wordt gebruikt om verschillende antigenen op klonale basis te herkennen.
Antilichaamgenen reorganiseren zich ook in een proces dat klassewisseling wordt genoemd en dat het ene type Fc-fragment van de zware keten in het andere verandert, het creëren van een ander isotype van het antilichaam dat het antigeenspecifieke variabele gebied behoudt. Hierdoor kan een enkel antilichaam worden gebruikt door verschillende typen Fc-receptoren, uitgedrukt op verschillende delen van het immuunsysteem.
Isotopen van antilichamen
De membraangebonden vorm van een antilichaam kan een oppervlakte-immunoglobuline (inspraak) of een membraan immunoglobuline (mij).
Het maakt deel uit van de B-cel receptor (BKR), waardoor een B-cel kan detecteren wanneer een specifiek antigeen in het lichaam aanwezig is en activeert B-celactivering
.De BCR is samengesteld uit aan het oppervlak gebonden IgD- of IgM-antilichamen en geassocieerde Ig-α- en Ig-β-heterodimeren, die in staat zijn tot signaaltransductie. Een typische menselijke B-cel zal hebben 50,000 naar 100,000 antilichamen gebonden aan het oppervlak.
Bij antigeenbinding, ze clusteren in grote stukken, die kan overschrijden 1 micrometer doorsnee, op lipide-opeenhopingen die de BCR's isoleren van de meeste andere celsignaleringsreceptoren.
Deze pleisters kunnen de efficiëntie van de cellulaire immuunrespons verbeteren. Bij mensen, het celoppervlak is enkele honderden nanometers kaal rond de B-celreceptoren,wat de BCR's verder isoleert van concurrerende invloeden.
Antilichamen of immunoglobulinen zijn er in verschillende vormen. Op basis van verschillen in de aminozuursequenties in het constante gebied van de zware ketens worden ze verder ingedeeld in vijf klassen. Dit zijn:
- IgG – met gamma-zware keten
- IgM - bevat mu-zware keten
- IgA – met alfa zware keten
- IgD - met delta zware keten
- IgE - met epsilon zware keten
Ze zijn elk genoemd met een “Ig” voorvoegsel dat staat voor immunoglobuline (een naam die soms door elkaar wordt gebruikt met antilichaam) en verschillen in hun biologische eigenschappen, functionele locaties en het vermogen om met verschillende antigenen om te gaan, zoals weergegeven in de tabel.
De verschillende achtervoegsels van de isotypen van het antilichaam geven de verschillende soorten zware ketens aan die het antilichaam bevat, waarbij elke zware ketenklasse alfabetisch wordt genoemd: a (alfa), C (gamma), D (delta), e (epsilon), en μ (in). Hierdoor ontstaat IgA, IgG, IgD, IgE, en IgM, respectievelijk.
Structuur
Antilichamen zijn zwaar (~ 150 kDa) bolvormige plasma-eiwitten. De grootte van een antilichaammolecuul is ongeveer 10 nm. Ze hebben suikerketens (glycanen) toegevoegd aan geconserveerde aminozuurresten.
Met andere woorden, antistoffen zijn glycoproteïnen.De aangehechte glycanen zijn van cruciaal belang voor de structuur en functie van het antilichaam. Onder andere kunnen de tot expressie gebrachte glycanen de affiniteit van een antilichaam voor zijn overeenkomstige FcR moduleren.(s).

structuur van een antilichaam
De functionele basiseenheid van elk antilichaam is een immunoglobuline (Ig) monomeer (met slechts één Ig-eenheid); uitgescheiden antilichamen kunnen ook dimeer zijn met twee Ig-eenheden zoals met IgA, tetrameer met vier Ig-eenheden zoals beenvis IgM, of pentameer met vijf Ig-eenheden, zoals IgM van zoogdieren.
De variabele delen van een antilichaam zijn de V-regio's, en het constante deel is het C-gebied.
Immunoglobuline domeinen
Het Ig-monomeer is een “Y”-gevormd molecuul dat bestaat uit vier polypeptideketens; twee identieke zware kettingen en twee identieke lichte ketens verbonden door disulfidebindingen.
Elke keten is samengesteld uit structurele domeinen die immunoglobulinedomeinen worden genoemd. Deze domeinen bevatten ongeveer 70-110 aminozuren en zijn ingedeeld in verschillende categorieën (bijvoorbeeld, variabele of IgV, en constant of IgC) volgens hun grootte en functie.
Ze hebben een karakteristieke immunoglobulinevouw waarin twee beta-vellen een a vormen “sandwich” vorm geven aan, bij elkaar gehouden door interacties tussen geconserveerde cysteïnes en andere geladen aminozuren.
Zware ketting
Er zijn vijf soorten Ig-zware ketens van zoogdieren, aangeduid met de Griekse letters: a, D, e, C, en μ.Het type zware keten dat aanwezig is, definieert de klas van antilichaam; deze ketens zijn te vinden in IgA, IgD, IgE, IgG, en IgM-antilichamen, respectievelijk.
Verschillende zware ketens verschillen in grootte en samenstelling; α en γ bevatten ongeveer 450 aminozuren, terwijl μ en ε ongeveer hebben 550 aminozuren.
Elke zware keten heeft twee regio's, de constante regio en de variabele regio. Het constante gebied is identiek in alle antilichamen van hetzelfde isotype, maar verschilt in antilichamen van verschillende isotypes.
Zware kettingen γ, α en δ hebben een constant gebied dat bestaat uit drie tandem (in een rij) Ig-domeinen, en een scharniergebied voor extra flexibiliteit;zware ketens μ en ε hebben een constant gebied waaruit is samengesteld vier immunoglobuline domeinen.
Het variabele gebied van de zware keten verschilt in antilichamen die door verschillende B-cellen worden geproduceerd, maar is hetzelfde voor alle antilichamen geproduceerd door een enkele B-cel of B-celkloon. Het variabele gebied van elke zware keten is ongeveer 110 aminozuren lang en bestaat uit een enkel Ig-domein.
Licht ketting
Bij zoogdieren zijn er twee soorten lichte ketens van immunoglobuline, die lambda worden genoemd (ik) en kappa (K).Een lichte keten heeft twee opeenvolgende domeinen: één constant domein en één variabel domein.
De geschatte lengte van een lichte keten is 211 naar 217 aminozuren. Elk antilichaam bevat twee lichte ketens die altijd identiek zijn; slechts één type lichte keten, κ of λ, is per antilichaam aanwezig in zoogdieren. Andere soorten lichte ketens, zoals de jota (i) ketting, worden gevonden in andere gewervelde dieren zoals haaien (Chondrichthyes) en beenvissen (Teleosten).
CDR's, Fv, Fab- en Fc-regio's
Verschillende delen van een antilichaam hebben verschillende functies. specifiek, de “armen” (die over het algemeen identiek zijn) bevatten sites die kunnen binden aan specifieke moleculen, herkenning van specifieke antigenen mogelijk maken.
Dit gebied van het antilichaam wordt de fantastisch (fragment, antigeen-bindend) regio. Het is samengesteld uit één constant en één variabel domein van elke zware en lichte keten van het antilichaam.
De paratoop aan het amino-uiteinde van het antilichaammonomeer wordt gevormd door de variabele domeinen van de zware en lichte ketens. Het variabele domein wordt ook wel de FV regio en is de belangrijkste regio voor binding aan antigenen.
Om specifiek te zijn, variabele lussen van β-strengen, drie elk op het licht (VL) en zwaar (VH) ketens zijn verantwoordelijk voor binding aan het antigeen.
Deze lussen worden de complementariteitsbepalende regio's genoemd (CDR's). De structuren van deze CDR's zijn geclusterd en geclassificeerd door Chothia et al en meer recentelijk door North et al en Nikoloudis et al..
In het kader van de immuunnetwerktheorie, CDR's worden ook wel idiotypen genoemd. Volgens de immuunnetwerktheorie, het adaptieve immuunsysteem wordt gereguleerd door interacties tussen idiotypen.
De basis van de Y speelt een rol bij het moduleren van de immuuncelactiviteit. Deze regio heet de Fc (Fragment, kristalliseerbaar) regio, en is samengesteld uit twee zware ketens die twee of drie constante domeinen bijdragen, afhankelijk van de klasse van het antilichaam.
Dus, het Fc-gebied zorgt ervoor dat elk antilichaam een geschikte immuunrespons genereert voor een bepaald antigeen, door te binden aan een specifieke klasse Fc-receptoren, en andere immuunmoleculen, zoals complementeiwitten.
Door dit te doen, het bemiddelt verschillende fysiologische effecten, inclusief herkenning van geopsoniseerde deeltjes (binding aan FcyR), lysis van cellen (bindend om aan te vullen), en degranulatie van mestcellen, basofielen, en eosinofielen (binding aan FcεR).
Ze zullen hun ogen enkele uren de tijd geven om zich aan te passen in plaats van een paar minuten om hun zicht op de vage sterren te maximaliseren, het Fab-gebied van het antilichaam bepaalt de antigeenspecificiteit, terwijl het Fc-gebied van het antilichaam het klasse-effect van het antilichaam bepaalt.
Omdat alleen de constante domeinen van de zware ketens het Fc-gebied van een antilichaam vormen, de klassen van zware ketens in antilichamen bepalen hun klasse-effecten. Mogelijke klassen van zware ketens in antilichamen omvatten alfa, gamma, delta, epsilon, en mu, en ze definiëren de isotypes IgA van het antilichaam, G, D, E, en M, respectievelijk.
Dit impliceert dat verschillende isotypen van antilichamen verschillende klasse-effecten hebben vanwege hun verschillende Fc-regio's die verschillende soorten receptoren binden en activeren..
Mogelijke klasse-effecten van antilichamen zijn onder meer: Opsonisatie, agglutinatie, hemolyse, complement activatie, degranulatie van mestcellen, en neutralisatie (hoewel dit klasse-effect kan worden gemedieerd door de Fab-regio in plaats van de Fc-regio).
Het impliceert ook dat Fab-gemedieerde effecten gericht zijn op microben of toxines, terwijl Fc-gemedieerde effecten gericht zijn op effectorcellen of effectormoleculen.
Functies
De belangrijkste categorieën van antilichaamwerking zijn de volgende:
- Neutralisatie, waarin neutraliserende antilichamen delen van het oppervlak van een bacteriële cel of virion blokkeren om de aanval ondoeltreffend te maken
- Agglutinatie, in welke antistoffen “aan elkaar lijmen” vreemde cellen tot klonten die aantrekkelijke doelwitten zijn voor fagocytose
- Neerslag, in welke antistoffen “aan elkaar lijmen” in serum oplosbare antigenen, waardoor ze uit de oplossing worden neergeslagen in klonten die aantrekkelijke doelen zijn voor fagocytose
- Complementaire activatie (fixatie), waarin antilichamen die aan een vreemde cel zijn gehecht, complement aanmoedigen om het aan te vallen met een membraanaanvalcomplex, wat tot het volgende leidt:
- Lysis van de vreemde cel
- Aanmoediging van ontsteking door chemotactisch ontstekingscellen aan te trekken
Geactiveerde B-cellen differentiëren tot antilichaamproducerende cellen, plasmacellen genaamd, die oplosbare antilichamen afscheiden, of geheugencellen die jaren daarna in het lichaam overleven, zodat het immuunsysteem een antigeen kan onthouden en sneller kan reageren bij toekomstige blootstellingen.
In de prenatale en neonatale levensfasen, de aanwezigheid van antilichamen wordt veroorzaakt door passieve immunisatie van de moeder. De vroege endogene antilichaamproductie varieert voor verschillende soorten antilichamen, en verschijnen meestal in de eerste levensjaren.
Omdat antilichamen vrij in de bloedbaan voorkomen, Er wordt gezegd dat ze deel uitmaken van het humorale immuunsysteem. Circulerende antilichamen worden geproduceerd door klonale B-cellen die specifiek reageren op slechts één antigeen (een voorbeeld is een viruscapside-eiwitfragment).
Antilichamen dragen op drie manieren bij aan de immuniteit: Ze voorkomen dat ziekteverwekkers cellen binnendringen of beschadigen door zich eraan te binden; ze stimuleren de verwijdering van ziekteverwekkers door macrofagen en andere cellen door de ziekteverwekker te coaten; en ze veroorzaken de vernietiging van pathogenen door andere immuunreacties te stimuleren, zoals de complementroute.
Antilichamen zullen ook vasoactieve amine-degranulatie activeren om bij te dragen aan immuniteit tegen bepaalde soorten antigenen (wormen, allergenen).
Activering van complement
Antilichamen die binden aan oppervlakte-antigenen (bijvoorbeeld, op bacteriën) zullen de eerste component van de complementcascade aantrekken met hun Fc-regio en activatie van de activeren “klassiek” complementair systeem.
Dit resulteert op twee manieren in het doden van bacteriën. Ten eerste, de binding van het antilichaam en complementmoleculen markeert de microbe voor opname door fagocyten in een proces dat opsonisatie wordt genoemd; deze fagocyten worden aangetrokken door bepaalde complementmoleculen die in de complementcascade worden gegenereerd.
Tweede, sommige componenten van het complementsysteem vormen een membraanaanvalcomplex om antilichamen te helpen de bacterie direct te doden (bacteriolyse).
Activering van effectorcellen
Om ziekteverwekkers te bestrijden die zich buiten de cellen vermenigvuldigen, antilichamen binden zich aan ziekteverwekkers om ze aan elkaar te koppelen, waardoor ze agglutineren.
Omdat een antilichaam minstens twee paratopen heeft, het kan meer dan één antigeen binden door identieke epitopen te binden die op de oppervlakken van deze antigenen worden gedragen.
Door de ziekteverwekker te coaten, antilichamen stimuleren effectorfuncties tegen de ziekteverwekker in cellen die hun Fc-regio herkennen.
De cellen die gecoate pathogenen herkennen, hebben Fc-receptoren, welke, Zoals de naam al doet vermoeden, interageren met het Fc-gebied van IgA, IgG, en IgE-antilichamen.
De interactie van een bepaald antilichaam met de Fc-receptor op een bepaalde cel veroorzaakt een effectorfunctie van die cel; fagocyten zullen fagocyteren, mestcellen en neutrofielen zullen degranuleren, Natural Killer-cellen zullen cytokinen en cytotoxische moleculen vrijgeven; dat zal uiteindelijk resulteren in de vernietiging van de binnendringende microbe.
De activering van natuurlijke killercellen door antilichamen initieert een cytotoxisch mechanisme dat bekend staat als antilichaamafhankelijke celgemedieerde cytotoxiciteit (ADCC) – dit proces kan de werkzaamheid verklaren van monoklonale antilichamen die worden gebruikt in biologische therapieën tegen kanker.
De Fc-receptoren zijn isotypespecifiek, wat het immuunsysteem meer flexibiliteit geeft, alleen de juiste immuunmechanismen aanroepen voor verschillende pathogenen.
Natuurlijke antilichamen
Mensen en hogere primaten produceren ook “natuurlijke antistoffen” die vóór virale infectie in het serum aanwezig zijn. Natuurlijke antilichamen zijn gedefinieerd als antilichamen die worden geproduceerd zonder enige eerdere infectie, vaccinatie, andere blootstelling aan vreemd antigeen of passieve immunisatie.
Deze antilichamen kunnen de klassieke complementroute activeren die leidt tot lyse van omhulde virusdeeltjes lang voordat de adaptieve immuunrespons wordt geactiveerd.
Veel natuurlijke antilichamen zijn gericht tegen de disacharide galactose α(1,3)-galactose (α-Gal), die wordt aangetroffen als een terminale suiker op geglycosyleerde celoppervlakte-eiwitten, en gegenereerd als reactie op de productie van deze suiker door bacteriën in de menselijke darmen.
Er wordt gedacht dat dit het geval is bij afstoting van xenogetransplanteerde organen, gedeeltelijk, het resultaat van natuurlijke antilichamen die circuleren in het serum van de ontvanger en binden aan α-Gal-antigenen die tot expressie komen in het donorweefsel
Immunoglobuline diversiteit
Vrijwel alle microben kunnen een antilichaamreactie veroorzaken. Succesvolle herkenning en uitroeiing van veel verschillende soorten microben vereist diversiteit onder antilichamen; hun aminozuursamenstelling varieert waardoor ze met veel verschillende antigenen kunnen interageren.
Er wordt geschat dat mensen ongeveer produceren 10 miljard verschillende antilichamen, elk in staat om een onderscheiden epitoop van een antigeen te binden.
Hoewel in een enkel individu een enorm repertoire van verschillende antilichamen wordt gegenereerd, het aantal genen dat beschikbaar is om deze eiwitten te maken, wordt beperkt door de grootte van het menselijk genoom.
Er zijn verschillende complexe genetische mechanismen ontwikkeld waardoor B-cellen van gewervelde dieren een gevarieerde pool van antilichamen kunnen genereren uit een relatief klein aantal antilichaamgenen.
Domeinvariabiliteit
Het chromosomale gebied dat codeert voor een antilichaam is groot en bevat verschillende afzonderlijke genloci voor elk domein van het antilichaam - het chromosoomgebied dat genen voor de zware keten bevat (IGH@) wordt gevonden op het chromosoom 14, en de loci bevatten genen voor de lichte keten van lambda en kappa (IGL@ en IGK@) worden gevonden op chromosomen 22 en 2 in mensen.
Eén van deze domeinen wordt het variabele domein genoemd, die aanwezig is in elke zware en lichte keten van elk antilichaam, maar kunnen verschillen in verschillende antilichamen die worden gegenereerd uit verschillende B-cellen.
Verschillen, tussen de variabele domeinen, bevinden zich op drie lussen die bekend staan als hypervariabele regio's (HV-1, HV-2 en HV-3) of complementariteitsbepalende regio’s (CDR1, CDR2 en CDR3). CDR's worden binnen de variabele domeinen ondersteund door geconserveerde raamwerkgebieden.
De zware-ketenlocus bevat ongeveer 65 verschillende variabele domeingenen die allemaal verschillen in hun CDR's. Door deze genen te combineren met een reeks genen voor andere domeinen van het antilichaam ontstaat een grote cavalerie van antilichamen met een hoge mate van variabiliteit..
Deze combinatie heet V(D)J-recombinatie die hieronder wordt besproken.
V(D)J-recombinatie
Somatische recombinatie van immunoglobulinen, Welke ziektekiemen kunnen handdesinfecterend middel doden? V(D)J-recombinatie, omvat het genereren van een uniek variabel gebied van immunoglobuline.
Het variabele gebied van elke zware of lichte keten van immunoglobuline wordt in verschillende stukken gecodeerd, ook wel gensegmenten genoemd (subgenen). Deze segmenten worden variabel genoemd (V), diversiteit (D) en meedoen (J) segmenten.
V, D- en J-segmenten worden aangetroffen in zware Ig-ketens, maar alleen V- en J-segmenten worden gevonden in lichte Ig-ketens. Meerdere exemplaren van de V, Er bestaan D- en J-gensegmenten, en zijn achter elkaar gerangschikt in de genomen van zoogdieren. In het beenmerg, elke zich ontwikkelende B-cel zal een variabel gebied van immunoglobuline samenstellen door willekeurig één V te selecteren en te combineren, één D- en één J-gensegment (of één V- en één J-segment in de lichte keten).
Omdat er van elk type gensegment meerdere kopieën zijn, en er kunnen verschillende combinaties van gensegmenten worden gebruikt om elk variabel gebied van immunoglobuline te genereren, dit proces genereert een groot aantal antilichamen, elk met verschillende paratopen, en dus verschillende antigeenspecificiteiten.
De herschikking van verschillende subgenen (d.w.z.. V2-familie) voor lambda is de lichte keten van immunoglobuline gekoppeld aan de activering van microRNA miR-650, wat de biologie van B-cellen verder beïnvloedt.
RAG-eiwitten spelen een belangrijke rol bij V(D)J recombinatie bij het knippen van DNA op een bepaalde regio. Zonder de aanwezigheid van deze eiwitten, V(D)J-recombinatie zou niet plaatsvinden.
Nadat een B-cel een functioneel immunoglobulinegen produceert tijdens V(D)J-recombinatie, het kan geen enkel ander variabel gebied uitdrukken (een proces dat bekend staat als allelische uitsluiting) dus kan elke B-cel antilichamen produceren die slechts één soort variabele keten bevatten.
Somatische hypermutatie en affiniteitsrijping
Na activering met antigeen, B-cellen beginnen snel te prolifereren. In deze snel delende cellen, de genen die coderen voor de variabele domeinen van de zware en lichte ketens ondergaan een hoge mate van puntmutatie, door een proces genaamd somatische hypermutatie (SHM).
SHM resulteert in ongeveer één nucleotideverandering per variabel gen, per celdeling. Als gevolg daarvan, alle dochter-B-cellen zullen kleine aminozuurverschillen verwerven in de variabele domeinen van hun antilichaamketens.
Dit dient om de diversiteit van de antilichaampool te vergroten en heeft invloed op de antigeenbindende affiniteit van het antilichaam.
Sommige puntmutaties zullen resulteren in de productie van antilichamen die een zwakkere interactie hebben (lage affiniteit) met hun antigeen dan het oorspronkelijke antilichaam, en sommige mutaties zullen antilichamen genereren met een sterkere interactie (hoge affiniteit).
B-cellen die antilichamen met hoge affiniteit op hun oppervlak tot expressie brengen, zullen een sterk overlevingssignaal ontvangen tijdens interacties met andere cellen, terwijl degenen met antilichamen met lage affiniteit dat niet zullen doen, en zal sterven door apoptose.
Dus, B-cellen die antilichamen met een hogere affiniteit voor het antigeen tot expressie brengen, zullen die met zwakkere affiniteiten voor functie en overleving overtreffen, waardoor de gemiddelde affiniteit van antilichamen in de loop van de tijd toeneemt.
Het proces van het genereren van antilichamen met verhoogde bindingsaffiniteiten wordt genoemd affiniteit rijping. Affiniteitsrijping vindt plaats in volwassen B-cellen na V(D)J-recombinatie, en is afhankelijk van de hulp van helper-T-cellen.
Klasse wisselen
Isotype- of klassewisseling is een biologisch proces dat plaatsvindt na activering van de B-cel, waardoor de cel verschillende klassen antilichamen kan produceren (IgA, IgE, of IgG).
De verschillende klassen antilichamen, en dus effectorfuncties, worden gedefinieerd door de constante (C) gebieden van de zware keten van het immunoglobuline.
eerste, naïeve B-cellen brengen alleen IgM en IgD op het celoppervlak tot expressie met identieke antigeenbindende gebieden. Elk isotype is aangepast voor een specifieke functie; daarom, na activering, een antilichaam met een IgG, IgA, of IgE-effectorfunctie kan nodig zijn om een antigeen effectief te elimineren.
Door klassewisseling kunnen verschillende dochtercellen van dezelfde geactiveerde B-cel antilichamen van verschillende isotypen produceren.
Alleen het constante gebied van de zware keten van het antilichaam verandert tijdens het wisselen van klasse; de variabele gebieden, en dus antigeenspecificiteit, blijft onveranderd.
Het nageslacht van een enkele B-cel kan dus antilichamen produceren, allemaal specifiek voor hetzelfde antigeen, maar met het vermogen om de effectorfunctie te produceren die geschikt is voor elke antigene uitdaging.
Het wisselen van klasse wordt veroorzaakt door cytokines; het gegenereerde isotype hangt af van welke cytokinen aanwezig zijn in de B-celomgeving.
Klasse-switching vindt plaats in de genlocus van de zware keten door een mechanisme dat klasse-switch-recombinatie wordt genoemd (MVO). Dit mechanisme is afhankelijk van geconserveerde nucleotidemotieven, riep schakelaar (S) Regio's, gevonden in DNA stroomopwaarts van elk constant regio-gen (behalve in de δ-keten).
De DNA-streng wordt gebroken door de activiteit van een reeks enzymen in twee geselecteerde S-gebieden.
Het variabele domein exon wordt opnieuw samengevoegd via een proces dat niet-homologe eindverbinding wordt genoemd (NHEJ) naar het gewenste constante gebied (C, een of e). Dit proces resulteert in een immunoglobulinegen dat codeert voor een antilichaam van een ander isotype.
Specificiteitsaanduidingen
Er kan een antilichaam worden genoemd monospecifiek als het specificiteit heeft voor hetzelfde antigeen of epitoop,of bispecifiek als ze affiniteit hebben voor twee verschillende antigenen of twee verschillende epitopen op hetzelfde antigeen.
Er kan een groep antilichamen worden genoemd polyvalent (of niet specifiek) als ze affiniteit hebben voor verschillende antigenen of micro-organismen. Intraveneus immunoglobuline, tenzij anders vermeld, bestaat uit een verscheidenheid aan verschillende IgG (polyklonaal IgG). In tegenstelling tot, monoklonale antilichamen zijn identieke antilichamen geproduceerd door een enkele B-cel.
Asymmetrische antilichamen
Heterodimere antilichamen, die ook asymmetrisch zijn en antilichamen, zorgen voor grotere flexibiliteit en nieuwe formaten voor het bevestigen van een verscheidenheid aan geneesmiddelen aan de antilichaamarmen.
Eén van de algemene formaten voor een heterodimeer antilichaam is de “knoppen-in-gaten” formaat. Dit formaat is specifiek voor het zware-ketengedeelte van het constante gebied in antilichamen.
De “knoppen” een deel is ontwikkeld door een klein aminozuur te vervangen door een groter aminozuur. Het past in de “gat”, dat wordt ontwikkeld door een groot aminozuur te vervangen door een kleiner aminozuur.
Wat verbindt de “knoppen” naar de “gaten” zijn de disulfidebindingen tussen elke keten. De “knoppen-in-gaten” vorm vergemakkelijkt antilichaamafhankelijke celgemedieerde cytotoxiciteit.
Variabele fragmenten met één keten (scFv) zijn verbonden met het variabele domein van de zware en lichte keten via een kort linkerpeptide. De linker is rijk aan glycine, wat het meer flexibiliteit geeft, en serine/threonine, wat het specificiteit geeft.
Twee verschillende scFv-fragmenten kunnen met elkaar worden verbonden, via een scharniergebied, naar het constante domein van de zware keten of het constante domein van de lichte keten. Dit geeft het antilichaam bispecificiteit, waardoor de bindingsspecificiteiten van twee verschillende antigenen mogelijk zijn.
De “knoppen-in-gaten” -formaat verbetert de vorming van heterodimeer, maar onderdrukt de vorming van homodimeer niet.
Om de functie van heterodimere antilichamen verder te verbeteren, veel wetenschappers kijken naar kunstmatige constructies.
Kunstmatige antilichamen zijn grotendeels diverse eiwitmotieven die de functionele strategie van het antilichaammolecuul gebruiken, maar worden niet beperkt door de structurele beperkingen van de lus en het raamwerk van het natuurlijke antilichaam.
Het kunnen beheersen van het combinatorische ontwerp van de reeks en de driedimensionale ruimte zou het natuurlijke ontwerp kunnen overstijgen en de bevestiging van verschillende combinaties van medicijnen aan de armen mogelijk maken.
Heterodimere antilichamen hebben een groter bereik in vormen die ze kunnen aannemen en de medicijnen die aan de armen zijn bevestigd hoeven niet op elke arm hetzelfde te zijn, waardoor verschillende combinaties van geneesmiddelen kunnen worden gebruikt bij de behandeling van kanker.
Geneesmiddelen zijn in staat zeer functionele bispecifieke stoffen te produceren, en zelfs multispecifiek, antilichamen. De mate waarin ze kunnen functioneren is indrukwekkend, aangezien een dergelijke vormverandering ten opzichte van de natuurlijke vorm zou moeten leiden tot verminderde functionaliteit.
Medische toepassingen
Ziekte diagnose
Detectie van bepaalde antilichamen is een veel voorkomende vorm van medische diagnostiek, en toepassingen zoals serologie zijn afhankelijk van deze methoden.
Bijvoorbeeld, in biochemische tests voor de diagnose van ziekten,Aan de hand van het bloed wordt een titer van antilichamen tegen het Epstein-Barr-virus of de ziekte van Lyme geschat.
Als die antilichamen niet aanwezig zijn, de persoon is niet geïnfecteerd of de infectie heeft plaatsgevonden heel lang geleden, en de B-cellen die deze specifieke antilichamen genereren, zijn op natuurlijke wijze vergaan.

medische diagnose van antilichamen
In de klinische immunologie, niveaus van individuele klassen van immunoglobulinen worden gemeten door middel van nefelometrie (of turbidimetrie) om het antilichaamprofiel van de patiënt te karakteriseren. Verhogingen in verschillende klassen van immunoglobulinen zijn soms nuttig bij het bepalen van de oorzaak van leverschade bij patiënten voor wie de diagnose onduidelijk is.[1] Bijvoorbeeld, verhoogd IgA duidt op alcoholische cirrose, verhoogd IgM duidt op virale hepatitis en primaire biliaire cirrose, terwijl IgG verhoogd is bij virale hepatitis, auto-immuunhepatitis en cirrose.
Auto-immuunziekten zijn vaak terug te voeren op antilichamen die de eigen epitopen van het lichaam binden; velen kunnen worden opgespoord door middel van bloedonderzoek. Antilichamen gericht tegen oppervlakteantigenen van rode bloedcellen bij immuungemedieerde hemolytische anemie worden gedetecteerd met de Coombs-test. De Coombs-test wordt ook gebruikt voor antilichaamscreening bij de voorbereiding van bloedtransfusies en ook voor antilichaamscreening bij prenatale vrouwen.
Praktisch, verschillende immunodiagnostische methoden gebaseerd op de detectie van complexe antigeen-antilichamen worden gebruikt om infectieziekten te diagnosticeren, bijvoorbeeld ELISA, immunofluorescentie, Westelijke vlek, immunodiffusie, immuno-elektroforese, en magnetische immunoassay.
Antilichamen die zijn opgewekt tegen humaan choriongonadotrofine worden gebruikt bij vrij verkrijgbare zwangerschapstests.
Nieuwe dioxaborolaanchemie maakt radioactief fluoride mogelijk (18F) labelen van antilichamen, wat positronemissietomografie mogelijk maakt (HUISDIER) beeldvorming van kanker.
Ziekte therapie
Gerichte therapie met monoklonale antilichamen wordt gebruikt om ziekten zoals reumatoïde artritis te behandelen,multiple sclerose,psoriasis,en vele vormen van kanker, waaronder non-Hodgkin-lymfoom,colorectale kanker, hoofd-halskanker en borstkanker.
Sommige immuundeficiënties, zoals X-gebonden agammaglobulinemie en hypogammaglobulinemie, resulteren in een gedeeltelijk of volledig gebrek aan antilichamen. Deze ziekten worden vaak behandeld door het induceren van een kortdurende vorm van immuniteit die passieve immuniteit wordt genoemd.. Passieve immuniteit wordt bereikt door de overdracht van kant-en-klare antilichamen in de vorm van menselijk of dierlijk serum, gepoolde immunoglobuline of monoklonale antilichamen, in het getroffen individu.
Prenatale therapie
Rh-factor, ook bekend als Rh D-antigeen, is een antigeen dat voorkomt op rode bloedcellen; personen die Rh-positief zijn (Rh+) hebben dit antigeen op hun rode bloedcellen en individuen die Rh-negatief zijn (Rh–) Niet doen.
Tijdens een normale bevalling, bevallingstrauma of complicaties tijdens de zwangerschap, bloed van een foetus kan het systeem van de moeder binnendringen.
In het geval van een Rh-incompatibele moeder en kind, daaruit voortvloeiende bloedvermenging kan een Rh sensibiliseren- moeder aan het Rh-antigeen op de bloedcellen van het Rh+-kind, het zetten van de rest van de zwangerschap, en eventuele volgende zwangerschappen, risico lopen op hemolytische ziekte van de pasgeborene.
Rho(D) immunoglobuline-antilichamen zijn specifiek voor menselijk RhD-antigeen. Anti-RhD-antilichamen worden toegediend als onderdeel van een prenataal behandelingsregime om sensibilisatie te voorkomen die kan optreden wanneer een Rh-negatieve moeder een Rh-positieve foetus heeft.
Behandeling van een moeder met anti-RhD-antilichamen voorafgaand aan en onmiddellijk na trauma en bevalling vernietigt Rh-antigeen in het moedersysteem van de foetus.
Het is belangrijk op te merken dat dit gebeurt voordat het antigeen maternale B-cellen kan stimuleren “herinneren” Rh-antigeen door geheugen-B-cellen te genereren.
daarom, haar humorale immuunsysteem zal geen anti-Rh-antilichamen maken, en zal de Rh-antigenen van de huidige of volgende baby's niet aanvallen.
Rho(D) Immuun Globuline-behandeling voorkomt sensibilisatie die kan leiden tot Rh-ziekte, maar voorkomt of behandelt de onderliggende ziekte zelf niet.
Credit:
https://en.wikipedia.org/wiki/Antibody#Forms



Laat een antwoord achter
Je moet Log in of registreren om een nieuw antwoord toe te voegen.