Verschil tussen waterstofbrug en metaalbinding
Wat is waterstofbinding??
Waterstofbinding is een vorm van intermoleculaire kracht die optreedt wanneer waterstof zich bindt met sterk elektronegatieve elementen zoals stikstof, zuurstof of fluor. In zo'n molecuul, het negatief geladen atoom heeft een gedeeltelijk negatieve lading, en waterstof heeft een gedeeltelijk positieve lading. De relatief geladen delen van de moleculen trekken elkaar sterk aan, zoals de polen van de magneten.
Wat is Metallic Bond??
Metaalbinding vindt plaats tussen atomen van een metaal. De buitenste elektronen van de metaalatomen raken los of “gedelokaliseerd.” Op dit punt behoren de gedelokaliseerde elektronen niet tot een bepaald atoom, maar worden ze gedeeld als een gemeenschappelijke “elektronenpool.” De positief geladen kernen van de atomen worden allemaal aangetrokken door deze elektronen, die een stuk metaal bij elkaar houdt.
Verschillen tussen metaal- en waterstofbinding
Metaalverbinding
Metalen worden gekenmerkt door heldere, glans, hoge elektrische en thermische geleidbaarheid, maakbaarheid, ductiliteit en hoge treksterkte. Een metaalkristal bestaat uit een zeer groot aantal atomen die in een regelmatig patroon zijn gerangschikt. Er zijn verschillende modellen voorgesteld om de aard van metaalbinding te verklaren. De twee belangrijkste modules zijn als volgt::
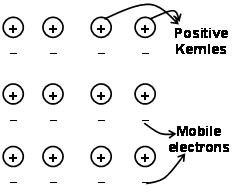
De krachten die de atomen in een metaal bij elkaar houden als gevolg van de aantrekking tussen positieve ionen en omringende vrij mobiele elektronen staan bekend als metaalbindingen.
Door de elektronenzee die voorafgaat aan de kwantummechanica, verklaart het nog steeds op bevredigende wijze bepaalde eigenschappen van de metalen. De elektrische en thermische geleidbaarheid van metalen bijvoorbeeld, kan worden verklaard door de aanwezigheid van mobiele elektronen in metalen. Over het aanleggen van een elektronenveld, deze mobiele elektronen geleiden elektriciteit door de metalen van het ene uiteinde naar het andere. evenzo, als een deel van metaal wordt verwarmd, de mobiele elektronen in het deel van de metalen krijgen een grote hoeveelheid kinetische energie. Vrij en mobiel zijn, deze elektronen bewegen snel door het metaal en geleiden warmte naar het andere deel van het metaal.
Voorwaarden voor metalen binding
Metaalbinding kan worden beschreven als het delen van vrije elektronen tussen positief geladen metalen Ionische roosters. De structuur van de metaalbinding is heel anders dan de structuur van de covalente binding en de ionische binding. In de metalen binding, de valentie-elektronen delokaliseren de S- en p-orbitalen van de op elkaar inwerkende metaalatomen. Dat is, ze draaien niet om hun respectieve metaalatomen, maar rond de positief geladen kernen van de op elkaar inwerkende metaalionen om de te vormen”zee” van elektronen. Dan bewegen de elektronen vrij in de ruimte tussen de kernen van het atoom.
Sleutels worden meestal gevormd omdat individuele atomen onstabiel zijn en bindingsvorming een stabielere structuur creëert.
Alle atomen hebben valentie-elektronen: het aantal groepen van het periodiek systeem vertelt je hoeveel valentie-elektronen een specifiek element of metaal hebben (dit verschilt van het d-blokelement, dat wil zeggen het overgangsmetaal).
Soorten metaalbinding
Metalen zijn meer vloeibaar maar niet echt kristallijn gebonden. D.w.z. Sommige zwevende elektronen rond de nauw verbonden atomen. Er bestaan drie toestanden van materie.
Kristal- regelmatig geordende reeks atomen/moleculen- vereist voor structuurbepaling door middel van röntgenchromatografie
Vloeistof-d.w.z.. Entiteiten in de buurt verplaatsen ( Ik kan het mis hebben, maar de manier waarop het mij werd uitgelegd, is dat "vast" geen toestand van materie is. Metalen zijn dichter bij liguiden. Sommige vloeistoffen hebben gedeeltelijke, onvolledige bindingen die in beweging zijn, d.w.z. Water Metaalverlijming. Ik heb het eigenlijk gewoon over pgf 1 van dit wiki-artikel. als je het artikel leest, het wordt ingewikkeld. Blijkbaar zijn metalen, zelfs als ze vast zijn, dichter bij vloeistoffen dan die van Chrystal en natuurlijk gassen.
Gas- verder verspreide entiteiten, d.w.z. Moleculen/atomen
Belang van metalen binding
metallic obligaties laat de elementen elektriciteit geleiden, ze kunnen in vormen worden gevormd en ze geleiden gemakkelijk warmte. Dit is de sterkste van de drie belangrijke obligaties omdat de elektronen in meer dan alleen de eerste schillen worden gedeeld. Hoe meer schillen betrokken zijn bij het delen van elektronen, hoe sterker de verbintenis.
Waterstofbinding
Een waterstofatoom covalent gebonden aan een sterk elektronegatief atoom kan een extra zwakke gehechtheid aan een ander elektronegatief atoom in dezelfde of verschillende moleculen. Deze bijlage wordt een waterstofbrug genoemd. Om te onderscheiden van een normale covalente binding, een waterstofbrug wordt weergegeven door een onderbroken lijn, bijv. X – H...Y waar X & Y zijn twee elektronegatieve atomen. De sterkte van de waterstofbrug is vrij laag over 2-10 kcal mol–1 of 8,4-42 kJ mol–1 in vergelijking met een covalente bindingssterkte 50-100 kcal mol–1 of 209 –419 kJ mol–1
Voorwaarden voor waterstofbinding
Waterstof moet worden gekoppeld aan een sterk elektronegatief element.
De grootte van het elektronegatieve element moet klein zijn.
Aan deze twee criteria wordt voldaan door F, de, en N in het periodiek systeem. Groter de elektronegativiteit en kleiner de grootte, Groter de elektronegativiteit en kleiner de grootte.
Groter de elektronegativiteit en kleiner de grootte
Groter de elektronegativiteit en kleiner de grootte:Groter de elektronegativiteit en kleiner de grootte. Bijvoorbeeld,
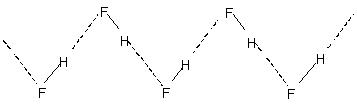
Groter de elektronegativiteit en kleiner de grootte. Groter de elektronegativiteit en kleiner de grootte. Groter de elektronegativiteit en kleiner de grootte. Dit wordt aangegeven in de relatief hogere kookpunten van waterstofgebonden vloeistoffen. Kristallijn waterstoffluoride bestaat uit het polymeer (HF)N. Dit heeft een zig-zag kettingstructuur met:
H-binding.
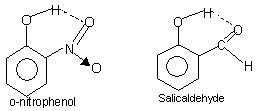
Intramoleculaire waterstofbinding: Dit type binding vindt plaats tussen atomen van hetzelfde molecuul die op verschillende plaatsen aanwezig zijn. Intramoleculaire waterstofbinding geeft aanleiding tot een gesloten ringstructuur waarvoor soms de term chelatie wordt gebruikt. Voorbeelden zijn
o-nitrofenol, salicylaldehyde.
Belang van waterstofbinding in biologische systemen
Waterstofbinding speelt een vitale rol in fysiologische systemen. Eiwitten bevatten ketens van aminozuren. De aminozuureenheden zijn gerangschikt in een spiraalvorm, enigszins als een uitgerekte spiraalveer (een helix vormen). De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten, De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten—De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten. De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten. De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten.
De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten. De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
- De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
- De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
- De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
- De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten
De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten.
Voorbeeld. H2De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten2De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten.
De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten: H2O kan intermoleculaire waterstofbruggen vormen. Dit is mogelijk vanwege de hoge elektronegativiteit en de kleine hoeveelheid zuurstof. Door intermoleculaire H-binding, moleculaire associatie vindt plaats. Als gevolg hiervan neemt het effectieve molecuulgewicht toe en daarmee het kookpunt. Dus H2O is een vloeistof. Maar in H2S geen waterstofbinding mogelijk vanwege grote omvang en minder elektronegativiteit van S. Het kookpunt is dus gelijk aan dat van een geïsoleerde H2S-molecuul en daarom is het een gas.
Voorbeeld.Ethylalcohol (C2H5OH) heeft een hoger kookpunt dan dimethylether (CH3-ALLEEN O-3) hoewel het molecuulgewicht van beide hetzelfde is.
De N-H-groep van elke aminozuureenheid en de vierde C=O-groep die erop volgt langs de keten: Hoewel ethylalcohol en dimethylether hetzelfde molecuulgewicht hebben, vormt in ethylalcohol de waterstof van de O-H-groepen een intermoleculaire waterstofbinding met de OH-groep in een ander molecuul. Maar in het geval van ether is de waterstof gekoppeld aan C niet zo elektronegatief om de waterstof aan te moedigen om van waterstofbinding te komen.
Door intermoleculaire H-binding, ethylalcohol blijft in de bijbehorende vorm en kookt daarom bij een hogere temperatuur in vergelijking met dimethylether.
Credit:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Laat een antwoord achter
Je moet Log in of registreren om een nieuw antwoord toe te voegen.