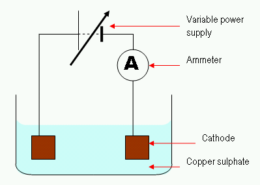
Por que o cobre é descarregado na eletrólise do cobre (II) Solução de sulfato?
No eletrólise de cobre (II) solução de sulfato, íons de cobre são descarregados em proporção à quantidade de cobre (II) íons dissolvidos na solução. Os íons descarregados são removidos da solução por uma variedade de processos, incluindo absorção por matéria sólida ou dissolução em água.
Em cobre (II) solução de sulfato, os íons de cobre estão ligados a ânions (sulfato) em uma reação redox. A reação global é:
2Cu(s) + 3H2O (eu) -> 2Cu2+ (aq) + 2SO4(aq)
Os íons cobre são liberados como resultado da redução dos íons SO4, o que resulta na formação de gás hidrogênio.
A descarga de cobre na eletrólise do cobre (II) solução de sulfato é devido aos seguintes motivos:
1. A dissolução do CuSO 4 na água libera íons Cu2+. Esses íons se combinam com elétrons das moléculas de água para formar H2O2.. Esta segunda reação é exotérmica e libera calor, que causa a descarga de cobre.
2. A dissociação de CuSO 4 em Cu e SO 4 2- íons também libera Cu2+ e SO4+. Esses íons se combinam com elétrons das moléculas de água para formar H2O e HSO4-. O resultado líquido é um aumento na concentração desses sais e uma diminuição na concentração de CuSO 4 .


Deixe uma resposta
Você deve Conecte-se ou registro para adicionar uma nova resposta.