Tofauti kati ya dhamana ya hidrojeni na dhamana ya metali
Dhamana ya hidrojeni ni nini?
Kifungo cha haidrojeni ni aina ya nguvu ya kati ya molekuli ambayo hutokea wakati vifungo vya hidrojeni vilivyo na vipengele vya elektroni kama vile nitrojeni., oksijeni au fluorine. Katika molekuli kama hiyo, atomi yenye chaji hasi ina chaji hasi kiasi, na hidrojeni ina chaji chanya kwa kiasi. Sehemu zenye chaji kiasi za molekuli huvutiana sana, kama nguzo za sumaku.
Bond ya Metallic ni nini?
Mshikamano wa metali hutokea kati ya atomi za chuma. Elektroni za nje za atomi za chuma huondolewa au “kutengwa.” Katika hatua hii elektroni zilizotengwa sio mali ya atomi yoyote lakini zinashirikiwa kama jumuiya. “bwawa la elektroni.” Nuclei chaji chanya za atomi zote huvutiwa na elektroni hizi, ambayo hushikilia kipande cha chuma pamoja.
Tofauti kati ya Bondi ya Metali na hidrojeni
Dhamana ya Metali
Vyuma vina sifa ya mkali, mng'aro, high conductivity ya umeme na mafuta, udhaifu, ductility na high tensile nguvu. Fuwele ya metali ina idadi kubwa sana ya atomi zilizopangwa kwa muundo wa kawaida. Miundo tofauti imependekezwa kuelezea asili ya kuunganisha kwa metali moduli mbili muhimu zaidi ni kama ifuatavyo:
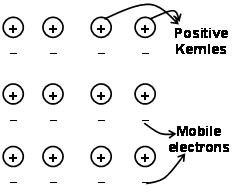
Nguvu zinazoshikilia atomi pamoja katika chuma kama matokeo ya mvuto kati ya ioni chanya na elektroni za rununu zinazozunguka hujulikana kama vifungo vya metali..
Kupitia bahari ya elektroni iliyotangulia mechanics ya quantum bado inaelezea kwa kuridhisha sifa fulani za metali.. Conductivity ya umeme na mafuta ya metali kwa mfano, inaweza kuelezewa na uwepo wa elektroni za rununu katika metali. Wakati wa kutumia uwanja wa elektroni, elektroni hizi za rununu hupitisha umeme katika metali zote kutoka upande mmoja hadi mwingine. Vile vile, ikiwa sehemu moja ya chuma inapokanzwa, elektroni za simu katika sehemu ya metali hupata kiasi kikubwa cha nishati ya kinetic. Kuwa huru na simu, elektroni hizi husogea kwa kasi kote kwenye chuma na kupeleka joto kwenye sehemu nyingine ya chuma.
Masharti ya Bondi ya Metallic
Kifungo cha metali kinaweza kuelezewa kama kushiriki elektroni zisizolipishwa kati ya lati za chuma zilizochajiwa chaji chanya za Ionic. Muundo wa dhamana ya chuma ni tofauti sana na muundo wa dhamana ya covalent na dhamana ya ionic. Katika dhamana ya chuma, elektroni za valence hupunguza obiti za S na p kutoka kwa atomi za chuma zinazoingiliana. Hiyo ni, hazizunguki kwenye atomi zao za chuma, lakini karibu na viini vilivyochajiwa vyema vya ioni za chuma zinazoingiliana ili kuunda”baharini” ya elektroni. Kisha elektroni huenda kwa uhuru katika nafasi kati ya nuclei ya atomi.
Funguo kawaida huundwa kwa sababu atomi za kibinafsi hazina msimamo na uundaji wa dhamana hutengeneza muundo thabiti zaidi.
Atomi zote zina elektroni za valence: idadi ya vikundi vya jedwali la mara kwa mara inakuambia ni elektroni ngapi za valence zilizo na kipengele maalum au chuma (hii inatofautiana na kipengele cha d-block, yaani chuma cha mpito).
Aina za Bond ya Metallic
Metali ni kioevu zaidi lakini haijafungwa kwa njia ya fuwele. Yaani. Baadhi ya elektroni zinazoelea karibu na atomi zinazohusiana kwa karibu.Kuna hali tatu za maada.
Kioo- safu zilizopangwa za kawaida za atomi/molekuli- inahitajika kwa uamuzi wa muundo kupitia chrystalography ya X-ray
Kioevu-yaani. Vyombo vinavyosonga kwa ukaribu ( Ninaweza kuwa nimekosea lakini jinsi nilivyoelezewa ni kwamba "imara" sio hali ya jambo. Vyuma ni karibu na liguids. Vimiminiko vingine vina sehemu, vifungo visivyo kamili ambavyo viko katika mtiririko i.e. Maji Kuunganishwa kwa metali. Kimsingi ninazungumza tu juu ya pgf 1 ya makala hii ya wiki. kama umesoma makala, inakuwa ngumu. Inavyoonekana metali hata ikiwa ngumu ziko karibu na vinywaji kuliko Chrystal na bila shaka gesi.
Gesi- vyombo vilivyotawanywa zaidi i.e. Molekuli/atomi
Umuhimu wa Bondi ya Metali
Vifungo vya metali kuruhusu vipengele vya kuendesha umeme, zinaweza kuunda maumbo na hufanya joto kwa urahisi. Huyu ndiye mwenye nguvu zaidi kati ya hao watatu vifungo kuu kwa sababu elektroni zinashirikiwa katika zaidi ya makombora ya kwanza. Magamba zaidi yanayohusika katika kugawana elektroni, nguvu zaidi dhamana.
Dhamana ya hidrojeni
Atomu ya hidrojeni iliyounganishwa kwa ushirikiano na atomi isiyo na nguvu ya elektroni inaweza kuanzisha dhaifu zaidi kiambatisho kwa atomi nyingine ya elektroni katika molekuli sawa au tofauti. Kiambatisho hiki kinaitwa dhamana ya hidrojeni. Ili kutofautisha kutoka kwa dhamana ya kawaida ya covalent, dhamana ya hidrojeni inawakilishwa na mstari uliovunjika mfano X - H…Y ambapo X & Y ni atomi mbili za elektroni. Nguvu ya dhamana ya hidrojeni ni ndogo sana 2-10 kcal mol-1 au 8.4-42 kJ mol-1 ikilinganishwa na covalent dhamana nguvu 50-100 kcal mol-1 au 209 -419 kJ mol-1
Masharti ya Kuunganisha haidrojeni
Haidrojeni inapaswa kuunganishwa na kipengele cha elektroni nyingi.
Ukubwa wa kipengele cha electronegative lazima iwe ndogo.
Vigezo hivi viwili vinatimizwa na F, O, na N katika jedwali la upimaji. Kubwa elektronegativity na ndogo ya kawaida, nguvu zaidi ni dhamana ya hidrojeni ambayo inaonekana kutokana na utaratibu wa jamaa wa nishati ya vifungo vya hidrojeni.
Aina za Kuunganishwa kwa hidrojeni
Kuunganisha kwa hidrojeni ya intermolecular:Aina hii ya kuunganisha hufanyika kati ya molekuli mbili za aina moja au tofauti. Kwa mfano,
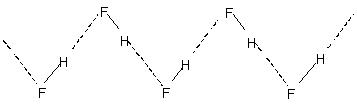
Uunganishaji wa haidrojeni kati ya molekuli husababisha uhusiano wa molekuli katika vimiminika kama vile maji n.k. Kwa hivyo katika maji ni asilimia chache tu ya molekuli za maji huonekana kuwa hazina hidrojeni hata ifikapo 90°C.. Kuvunjwa kwa vifungo hivyo vya hidrojeni kwenye kioevu chote kunahitaji nishati ya joto inayostahili. Hii inaonyeshwa katika viwango vya juu zaidi vya kuchemsha vya vimiminika vilivyounganishwa na hidrojeni. Fluoridi hidrojeni ya fuwele ina polima (HF)n. Hii ina muundo wa mnyororo wa zig-zag unaohusisha
H-bondi.
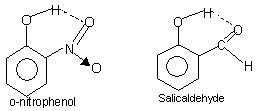
Kuunganisha kwa hidrojeni ya ndani ya molekuli: Aina hii ya kuunganisha hutokea kati ya atomi za molekuli sawa zilizopo kwenye tovuti tofauti. Uunganishaji wa hidrojeni ndani ya molekuli husababisha muundo wa pete funge ambao neno chelation hutumiwa wakati mwingine. Mifano ni
o-nitrophenol, salicylaldehyde.
Umuhimu wa Kuunganisha haidrojeni katika Mifumo ya Kibiolojia
Uunganisho wa haidrojeni una jukumu muhimu katika mifumo ya kisaikolojia. Protini zina minyororo ya asidi ya amino. Vitengo vya asidi ya amino vimepangwa katika umbo la ond kwa kiasi fulani kama chemchemi ya koili iliyonyoshwa (kutengeneza helix). Kikundi cha N-H cha kila kitengo cha asidi ya amino na kikundi cha nne cha C=O kinachofuata kwenye mnyororo, inaanzisha N-H—O vifungo vya hidrojeni. Vifungo hivi ni sehemu ya kuwajibika kwa utulivu wa muundo wa ond. Muundo wa helix mbili wa DNA pia una nyuzi mbili zinazounda helix mbili na zimeunganishwa kwa kila mmoja kupitia dhamana ya hidrojeni..
Madhara ya Kuunganisha Hidrojeni
Uunganishaji wa haidrojeni umepata athari wazi juu ya sifa fulani za molekuli. Wana madhara
- Hali ya dutu
- Umumunyifu wa dutu
- Kuchemka
- Asidi ya isoma tofauti
Haya yanaweza kudhihirika kutokana na mifano ifuatayo.
Mfano. H2O ni kioevu kwenye joto la kawaida wakati H2S ni gesi ingawa zote O na S ni za kundi moja la jedwali la upimaji.
Suluhisho: H2O ina uwezo wa kutengeneza vifungo vya hidrojeni vya intermolecular. Hii inawezekana kutokana na high electronegativity na saizi ndogo ya oksijeni. Kutokana na kuunganisha H-intermolecular, muungano wa molekuli hufanyika. Matokeo yake uzito wa Masi huongezeka na hivyo kiwango cha kuchemsha huongezeka. Kwa hivyo H2O ni kioevu. Lakini katika H2S hakuna uunganishaji wa hidrojeni unaowezekana kwa sababu ya saizi kubwa na uwezo mdogo wa kielektroniki wa S. Kwa hivyo kiwango cha mchemko ni sawa na ile ya H2S molekuli na kwa hiyo ni gesi.
Mfano.Pombe ya ethyl (C2H5OH) ina kiwango cha juu cha mchemko kuliko dimethyl etha (CH3-O-TU3) ingawa uzito wa molekuli ya zote mbili ni sawa.
Suluhisho: Ingawa pombe ya ethyl na etha ya dimethyl zina uzito sawa wa molekuli lakini katika pombe ya ethyl hidrojeni ya vikundi vya O-H huunda uhusiano wa hidrojeni kati ya molekuli na kundi la OH katika molekuli nyingine.. Lakini katika kesi ya etha hidrojeni inaunganishwa na C sio elektroni ili kuhimiza hidrojeni kutoka kwa uunganisho wa hidrojeni..
Kutokana na kuunganisha H-intermolecular, pombe ya ethyl inabakia katika fomu inayohusishwa na kwa hiyo inachemka kwa joto la juu ikilinganishwa na dimethyl ether.
Mikopo:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Acha jibu
Lazima Ingia au kujiandikisha kuongeza jibu jipya.