氢键和金属键的区别
什么是氢键?
氢键是一种分子间力,当氢与高负电性元素(如氮)键合时发生, 氧气或氟. 在这样的分子中, 带负电荷的原子带有部分负电荷, 氢带有部分正电荷. 分子中相对带电的部分强烈地相互吸引, 就像磁铁的两极.
什么是金属键?
金属原子之间发生金属键. 金属原子的最外层电子脱落或 “离域的。” 此时,离域电子不属于任何特定原子,而是作为公共 “电子池。” 带正电荷的原子核都被这些电子吸引, 将一块金属固定在一起.
金属键和氢键的区别
金属键
金属的特点是光亮, 光泽, 高导电性和导热性, 延展性, 延展性和高抗拉强度. 金属晶体由大量以规则排列的原子组成. 已经提出了不同的模型来解释金属键合的性质,两个最重要的模块如下:
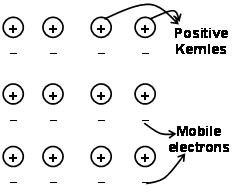
由于正离子和周围可自由移动的电子之间的吸引力,将金属中的原子保持在一起的力称为金属键.
通过早于量子力学的电子海,它仍然令人满意地解释了金属的某些特性. 例如金属的导电性和导热性, 可以通过金属中存在移动电子来解释. 关于施加电子场, 这些移动电子从一端到另一端在整个金属中导电. 同样, 如果一部分金属被加热, 部分金属中的移动电子获得大量的动能. 自由和移动, 这些电子在整个金属中快速移动并将热量传导到金属的另一部分.
金属键的条件
金属键可以描述为在带正电的金属离子晶格之间共享自由电子. 金属键的结构与共价键和离子键的结构有很大不同. 在金属键, 价电子使 S 和 p 轨道与相互作用的金属原子离域. 那是, 它们不围绕各自的金属原子旋转, 但是在相互作用的金属离子的带正电的原子核周围形成”海” 电子. 然后电子在原子核之间的空间中自由移动.
通常形成键是因为单个原子不稳定并且键的形成会产生更稳定的结构.
所有原子都有价电子: 元素周期表的组数告诉您有多少价电子具有特定元素或金属 (这与 d-block 元素不同, 即过渡金属).
金属键的类型
金属更具流动性,但并没有真正以结晶方式结合. IE. 一些漂浮在紧密结合的原子周围的电子。物质存在三种状态.
水晶- 原子/分子的规则有序阵列- 通过 X 射线晶体学确定结构所需的
液体-即. 移动靠近的实体 ( 我可能错了,但向我解释的方式是“固体”不是物质状态. 金属更接近液体. 有些液体有部分, 不断变化的不完整键,即. 水 金属键合. 我基本上只是在谈论 pgf 1 这篇维基文章的. 如果你读了这篇文章, 它变得复杂. 显然金属,即使固体比水晶更接近液体,当然还有气体.
气体- 进一步分散的实体,即. 分子/原子
金属键的重要性
金属键 让元素导电, 它们可以成型并且容易导热. 这是三个中最强的 主要债券 因为电子不仅在第一个壳层中共享. 参与共享电子的壳层越多, 越强 键.
氢键
与强电负性原子共价连接的氢原子可以建立一个额外的弱电 连接到相同或不同分子中的另一个电负性原子. 这种连接称为氢键. 与正常的共价键区分开来, 氢键用虚线表示,例如 X – H...Y 哪里 X & Y 是两个电负性原子. 氢键强度很低 2-10 千卡摩尔–1 或 8.4–42 kJ 摩尔–1 与 50–100 kcal mol 的共价键强度相比–1 要么 209 –419 千焦摩尔–1
氢键条件
氢应与高电负性元素相连.
电负性元件的尺寸必须很小.
F满足这两个条件, 该, 和元素周期表中的N. 电负性越大,尺寸越小, 从氢键能量的相对顺序可以看出,氢键越强.
氢键的类型
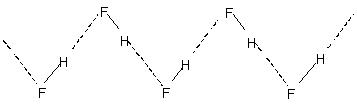
分子间氢键:这种类型的键合发生在两个相同或不同类型的分子之间. 例如,
分子间氢键导致水等液体中的分子缔合. 因此,在水中,即使在 90°C 下,也只有百分之几的水分子似乎没有氢键. 在整个液体中破坏这些氢键需要可观的热能. 氢键液体的沸点相对较高表明了这一点. 结晶氟化氢由聚合物组成 (高频)n. 这具有锯齿形链结构,涉及
氢键.
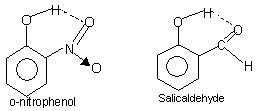
分子内氢键: 这种类型的键合发生在存在于不同位置的同一分子的原子之间. 分子内氢键产生闭合环结构,有时使用术语螯合. 例子是
邻硝基苯酚, 水杨醛.
氢键在生物系统中的重要性
氢键在生理系统中起着至关重要的作用. 蛋白质含有氨基酸链. 氨基酸单元呈螺旋状排列,有点像拉伸的螺旋弹簧 (形成螺旋). 每个氨基酸单元的 N-H 基团和沿着链的第四个 C=O 基团, 建立 N-H—O氢键. 这些键部分负责螺旋结构的稳定性. DNA的双螺旋结构也由两条形成双螺旋的链组成,并通过氢键相互连接.
氢键的影响
氢键对分子的某些特性产生了非常显着的影响. 他们对
- 物质状态
- 物质的溶解度
- 沸点
- 不同异构体的酸度
这些可以从以下示例中明显看出.
例. H2O在常温下是液体,而H2S 是一种气体,尽管 O 和 S 都属于元素周期表的同一组.
解决方案: H2O能够形成分子间氢键. 这是可能的,因为高电负性和小尺寸的氧气. 由于分子间氢键, 发生分子结合. 结果,有效分子量增加,因此沸点增加. 所以H2O是液体. 但在 H2S 由于 S 的尺寸大且电负性较小,因此无法形成氢键. 所以它的沸点等于一个孤立的H2S分子,因此它是一种气体.
例.乙醇 (C2H5哦) 沸点比二甲醚高 (CH3-O-ONLY3) 虽然两者的分子量相同.
解决方案: 虽然乙醇和二甲醚具有相同的分子量,但在乙醇中,OH 基团的氢与另一个分子中的 OH 基团形成分子间氢键. 但在乙醚的情况下,氢与 C 相连的电负性不强,无法促使氢形成氢键.
由于分子间氢键, 乙醇保持缔合形式,因此与二甲醚相比沸腾温度更高.
信用:HTTPS://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


离开一个答案
你必须 登录 要么 寄存器 添加新答案.