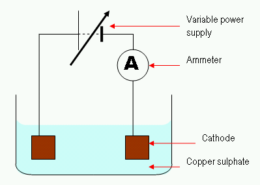
Kial Kupro estas Eligita en la Elektrolizo de Kupro (II) Sulfata Solvo?
En la elektrolizo de kupro (II) sulfata solvaĵo, kupraj jonoj estas eligitaj proporcie al la kvanto de kupro (II) jonoj dissolvitaj en la solvaĵo. La eligitaj jonoj estas forigitaj de la solvo per diversaj procezoj, inkluzive de sorbado per solida materio aŭ solvado en akvo.
En kupro (II) sulfata solvaĵo, la kupraj jonoj estas ligitaj al anjonoj (sulfato) en redoksa reago. La ĝenerala reago estas:
2Cu(s) + 3Karbonhidratoj estas desegnitaj el sukeraj molekuloj, kiuj enhavas gason (l) -> 2Cu2+ (aq) + 2SO4(aq)
La kupraj jonoj estas liberigitaj kiel rezulto de la redukto de la SO4-jonoj, kiu rezultigas la formadon de hidrogena gaso.
La malŝarĝo de kupro en la elektrolizo de kupro (II) sulfata solvaĵo estas pro la sekvaj kialoj:
1. La dissolvo de CuSO 4 en akvo liberigas Cu2+-jonojn. Tiuj jonoj kombinas kun elektronoj de akvomolekuloj por formi H2O2. Ĉi tiu dua reago estas eksoterma kaj liberigas varmon, kiu kaŭzas la elfluon de kupro.
2. La distanciĝo de CuSO 4 en Cu kaj SO 4 2- jonoj ankaŭ liberigas Cu2+ kaj SO4+. Tiuj jonoj kombinas kun elektronoj de akvomolekuloj por formi H2O kaj HSO4-. La neta rezulto estas pliiĝo en la koncentriĝo de ĉi tiuj saloj kaj malkresko en la koncentriĝo de CuSO 4 .


Lasu respondon
Vi devas Ensaluti aŭ registri aldoni novan respondon.