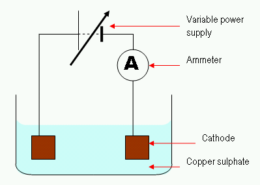
Pourquoi le cuivre est-il déchargé dans l'électrolyse du cuivre (II) Solution de sulfate?
dans le électrolyse du cuivre (II) solution de sulfate, les ions cuivre sont évacués proportionnellement à la quantité de cuivre (II) ions dissous dans la solution. Les ions déchargés sont éliminés de la solution par une variété de processus, y compris l'absorption par une matière solide ou la dissolution dans l'eau.
En cuivre (II) solution de sulfate, les ions cuivre sont liés aux anions (sulfate) dans une réaction redox. La réaction globale est:
2Cu(s) + 3H2O (l) -> 2Cu2+ (aq) + 2SO4(aq)
Les ions cuivre sont libérés suite à la réduction des ions SO4, ce qui entraîne la formation d’hydrogène gazeux.
La décharge du cuivre lors de l'électrolyse du cuivre (II) la solution de sulfate est due aux raisons suivantes:
1. La dissolution de CuSO 4 dans l'eau libère des ions Cu2+. Ces ions se combinent avec les électrons des molécules d'eau pour former H2O2. Cette seconde réaction est exothermique et dégage de la chaleur, ce qui provoque le rejet de cuivre.
2. La dissociation de CuSO 4 en Cu et SO 4 2- les ions libèrent également Cu2+ et SO4+. Ces ions se combinent avec les électrons des molécules d'eau pour former H2O et HSO4-. Le résultat net est une augmentation de la concentration de ces sels et une diminution de la concentration de CuSO 4 .


Laisser une réponse
Vous devez s'identifier ou S'inscrire ajouter une nouvelle réponse.