Differenza tra legame idrogeno e legame metallico
Cos'è Hydrogen Bond?
Il legame idrogeno è una forma di forza intermolecolare che si verifica quando l'idrogeno si lega con elementi altamente elettronegativi come l'azoto, ossigeno o fluoro. In una tale molecola, l'atomo caricato negativamente ha una carica parzialmente negativa, e l'idrogeno ha una carica parzialmente positiva. Le parti relativamente cariche delle molecole si attraggono fortemente a vicenda, come i poli dei magneti.
Cos'è Metallic Bond?
Il legame metallico si verifica tra gli atomi di un metallo. Gli elettroni più esterni degli atomi di metallo vengono spostati o “delocalizzato.” A questo punto gli elettroni delocalizzati non appartengono a nessun atomo particolare ma sono condivisi come un comune “pool di elettroni.” I nuclei a carica positiva degli atomi sono tutti attratti da questi elettroni, che tiene insieme un pezzo di metallo.
Differenze tra legame metallico e legame idrogeno
Legame metallico
I metalli sono caratterizzati da brillante, lustro, elevata conducibilità elettrica e termica, malleabilità, duttilità e alta resistenza alla trazione. Un cristallo metallico è costituito da un numero molto elevato di atomi disposti in uno schema regolare. Sono stati proposti modelli diversi per spiegare la natura del legame metallico, i due moduli più importanti sono i seguenti:
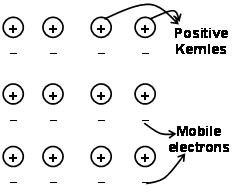
Le forze che tengono insieme gli atomi in un metallo come risultato dell'attrazione tra gli ioni positivi e gli elettroni liberamente mobili circostanti sono note come legami metallici.
Attraverso il mare degli elettroni, precedente alla meccanica quantistica, spiega ancora in modo soddisfacente alcune proprietà dei metalli. Ad esempio, la conduttività elettrica e termica dei metalli, può essere spiegato dalla presenza di elettroni mobili nei metalli. Sull'applicazione di un campo di elettroni, questi elettroni mobili conducono l'elettricità attraverso i metalli da un'estremità all'altra. allo stesso modo, se una parte di metallo viene riscaldata, gli elettroni mobili nella parte dei metalli acquisiscono una grande quantità di energia cinetica. Essere liberi e mobili, questi elettroni si muovono rapidamente attraverso il metallo e conducono il calore all'altra parte del metallo.
Condizioni per l'adesione metallica
Il legame metallico può essere descritto come la condivisione di elettroni liberi tra reticoli ionici metallici caricati positivamente. La struttura del legame metallico è molto diversa dalla struttura del legame covalente e del legame ionico. Nel legame metallico, gli elettroni di valenza delocalizzano gli orbitali S ep dagli atomi metallici interagenti. Questo è, non ruotano attorno ai rispettivi atomi di metallo, ma attorno ai nuclei caricati positivamente degli ioni metallici interagenti per formare il”mare” di elettroni. Quindi gli elettroni si muovono liberamente nello spazio tra i nuclei dell'atomo.
Le chiavi si formano solitamente perché i singoli atomi sono instabili e la formazione di legami crea una struttura più stabile.
Tutti gli atomi hanno elettroni di valenza: il numero di gruppi della tavola periodica ti dice quanti elettroni di valenza hanno un elemento o metallo specifico (questo differisce dall'elemento d-block, cioè il metallo di transizione).
Tipi di legame metallico
I metalli sono più liquidi ma non realmente legati in modo cristallino. Cioè. Alcuni elettroni fluttuanti attorno agli atomi strettamente associati. Esistono tre stati della materia.
Cristallo- matrice ordinata regolare di atomi / molecole- necessaria per la determinazione della struttura mediante la cristallografia a raggi X.
Liquido-vale a dire. Spostamento di entità vicine ( Potrei sbagliarmi, ma il modo in cui mi è stato spiegato è che "solido" non è uno stato della materia. I metalli sono più vicini ai liguidi. Alcuni liquidi hanno una parziale, legami incompleti che sono in flusso cioè. acqua Incollaggio metallico. Fondamentalmente sto solo parlando di PGF 1 di questo articolo wiki. se leggi l'articolo, diventa complicato. Apparentemente i metalli, anche se solidi, sono più vicini ai liquidi rispetto a quelli di Chrystal e, naturalmente, ai gas.
Gas- entità ulteriormente disperse i.e. Molecole / atomi
Importanza del legame metallico
Legami metallici consentire agli elementi di condurre l'elettricità, possono essere formati in forme e conducono facilmente il calore. Questo è il più forte dei tre obbligazioni importanti perché gli elettroni sono condivisi in più che solo i primi gusci. Più gusci sono coinvolti nella condivisione di elettroni, più forte è il legame.
Legame idrogeno
Un atomo di idrogeno legato covalentemente a un atomo fortemente elettronegativo può stabilire un extra debole attaccamento a un altro atomo elettronegativo nelle stesse o diverse molecole. Questo attaccamento è chiamato legame idrogeno. Da distinguere da un normale legame covalente, un legame idrogeno è rappresentato da una linea tratteggiata ad esempio X - H...Y dove X & Y sono due atomi elettronegativi. La forza del legame idrogeno è piuttosto bassa 2-10 kcal mol–1 o 8,4–42 kJ mol–1 rispetto a una forza di legame covalente di 50-100 kcal mol–1 o 209 –419 kJ mol–1
Condizioni per il legame idrogeno
L'idrogeno dovrebbe essere collegato a un elemento altamente elettronegativo.
La dimensione dell'elemento elettronegativo deve essere piccola.
Questi due criteri sono soddisfatti da F, O, e N nella tavola periodica. Maggiore è l'elettronegatività e minore è la dimensione, più forte è il legame idrogeno che è evidente dall'ordine relativo delle energie dei legami idrogeno.
Tipi di legame idrogeno
Legame idrogeno intermolecolare:Questo tipo di legame avviene tra due molecole dello stesso tipo o di tipi diversi. Per esempio,
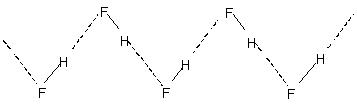
Il legame idrogeno intermolecolare porta all'associazione molecolare in liquidi come l'acqua, ecc. Così nell'acqua solo una piccola percentuale delle molecole d'acqua sembra non essere legata all'idrogeno anche a 90 ° C. La rottura di quei legami idrogeno in tutto il liquido richiede un'apprezzabile energia termica. Ciò è indicato nei punti di ebollizione relativamente più alti dei liquidi legati all'idrogeno. Il fluoruro di idrogeno cristallino è costituito dal polimero (HF)n. Questo ha una struttura a catena a zig-zag che coinvolge
H-bond.
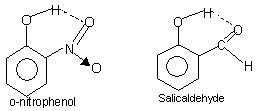
Legame idrogeno intramolecolare: Questo tipo di legame avviene tra atomi della stessa molecola presenti in siti differenti. Il legame idrogeno intramolecolare dà origine a una struttura ad anello chiuso per la quale a volte viene utilizzato il termine chelazione. Gli esempi sono
o-nitrofenolo, salicilaldeide.
Importanza del legame idrogeno nei sistemi biologici
Il legame idrogeno svolge un ruolo fondamentale nei sistemi fisiologici. Le proteine contengono catene di amminoacidi. Le unità di amminoacidi sono disposte in una forma a spirale un po 'come una molla elicoidale allungata (formando un'elica). Il gruppo N-H di ciascuna unità amminoacidica e il quarto gruppo C = O che lo segue lungo la catena, stabilisce la N – H—O legami idrogeno. Questi legami sono in parte responsabili della stabilità della struttura a spirale. La struttura a doppia elica del DNA è costituita anche da due filamenti che formano una doppia elica e sono uniti tra loro attraverso il legame a idrogeno.
Effetto del legame idrogeno
Il legame idrogeno ha effetti molto pronunciati su alcune proprietà delle molecole. Hanno effetti su
- Stato della sostanza
- Solubilità della sostanza
- Punto di ebollizione
- Acidità di diversi isomeri
Questi possono essere evidenti dai seguenti esempi.
Esempio. H2O è un liquido a temperatura ordinaria mentre H2S è un gas sebbene sia O che S appartengano allo stesso gruppo della tavola periodica.
Soluzione: H2O è in grado di formare legami idrogeno intermolecolari. Ciò è possibile grazie all'elevata elettronegatività e alle ridotte dimensioni dell'ossigeno. A causa del legame H intermolecolare, ha luogo l'associazione molecolare. Di conseguenza il peso molecolare effettivo aumenta e quindi il punto di ebollizione aumenta. Quindi H2O è un liquido. Ma in H2S nessun legame idrogeno è possibile a causa delle grandi dimensioni e della minore elettronegatività di S. Quindi il punto di ebollizione è uguale a quello di una H isolata2Molecola S e quindi è un gas.
Esempio.Alcol etilico (C2H5OH) ha un punto di ebollizione più alto dell'etere dimetilico (CH3-O-CH3) sebbene il peso molecolare di entrambi sia lo stesso.
Soluzione: Sebbene l'alcol etilico e l'etere dimetilico abbiano lo stesso peso molecolare, ma nell'alcool etilico l'idrogeno dei gruppi O-H forma un legame idrogeno intermolecolare con il gruppo OH in un'altra molecola. Ma nel caso dell'etere l'idrogeno è legato a C non è così elettronegativo da incoraggiare l'idrogeno a uscire dal legame idrogeno.
A causa del legame H intermolecolare, l'alcol etilico rimane nella forma associata e quindi bolle a una temperatura più elevata rispetto all'etere dimetilico.
Credito:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Lascia una risposta
Devi accesso o Registrati per aggiungere una nuova risposta.