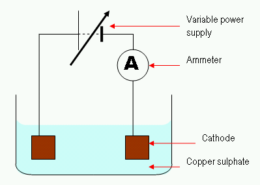
Perché il rame viene scaricato nell'elettrolisi del rame (II) Soluzione di solfato?
Nel elettrolisi del rame (II) soluzione di solfato, gli ioni di rame vengono scaricati in proporzione alla quantità di rame (II) ioni disciolti nella soluzione. Gli ioni scaricati vengono rimossi dalla soluzione mediante una varietà di processi, compreso l'assorbimento da parte di materia solida o la dissoluzione in acqua.
In rame (II) soluzione di solfato, gli ioni rame sono legati agli anioni (solfato) in una reazione redox. La reazione generale è:
2Cu(S) + 3H2O (l) -> 2Cu2+ (aq) + 2SO4(aq)
Gli ioni rame vengono rilasciati a seguito della riduzione degli ioni SO4, che porta alla formazione di gas idrogeno.
Lo scarico del rame nell'elettrolisi del rame (II) soluzione di solfato è dovuto ai seguenti motivi:
1. Lo scioglimento del CuSO 4 in acqua libera ioni Cu2+. Questi ioni si combinano con gli elettroni delle molecole d'acqua per formare H2O2. Questa seconda reazione è esotermica e rilascia calore, che provoca la fuoriuscita del rame.
2. La dissociazione di CuSO 4 in Cu e SO 4 2- gli ioni rilasciano anche Cu2+ e SO4+. Questi ioni si combinano con gli elettroni delle molecole d'acqua per formare H2O e HSO4-. Il risultato netto è un aumento della concentrazione di questi sali e una diminuzione della concentrazione di CuSO 4 .


Lascia una risposta
Devi accesso o Registrati per aggiungere una nuova risposta.