Diferença entre ligação de hidrogênio e ligação metálica
O que é ligação de hidrogênio?
ligação de hidrogénio é uma forma de força intermolecular que ocorre quando ligações de hidrogénio com elementos altamente electronegativos, tais como azoto, oxigénio ou flúor. Na molécula tal, o átomo carregado negativamente tem uma carga negativa parcialmente, e hidrogio tem uma carga positiva parcialmente. As partes relativamente carregadas das moléculas atrair fortemente uns aos outros, como os pólos dos ímãs.
O que é metálica de Bond?
ligação metálica ocorre entre os átomos de um metal. Os electrões exteriores dos átomos metálicos ser desalojada ou “deslocalizado.” Neste ponto, os elétrons deslocalizados não pertencem a nenhum átomo em particular, mas são compartilhados como um grupo comum. “pool de elétrons.” Os núcleos de carga positiva dos átomos são todos atraídos por esses elétrons, que une um pedaço de metal.
Diferenças entre ligação metálica e de hidrogênio
Ligação metálica
Os metais são caracterizados por, brilho, alta condutividade elétrica e térmica, maleabilidade, ductilidade e alta resistência à tração. Um cristal metálico consiste em um número muito grande de átomos dispostos em um padrão regular. Diferentes modelos foram propostos para explicar a natureza da ligação metálica, dois módulos mais importantes são os seguintes:
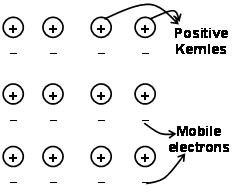
As forças que mantêm os átomos unidos em um metal, como resultado da atração entre íons positivos e elétrons livremente móveis circundantes, são conhecidas como ligações metálicas..
Através do mar de elétrons anterior à mecânica quântica, ela ainda explica satisfatoriamente certas propriedades dos metais. A condutividade elétrica e térmica de metais, por exemplo, pode ser explicado pela presença de elétrons móveis em metais. Ao aplicar um campo de elétrons, esses elétrons móveis conduzem eletricidade através dos metais de uma extremidade a outra. similarmente, se uma parte do metal for aquecida, os elétrons móveis na parte dos metais adquirem uma grande quantidade de energia cinética. Ser gratuito e móvel, esses elétrons se movem rapidamente por todo o metal e conduzem calor para a outra parte do metal.
Condições para Ligação Metálica
A ligação metálica pode ser descrita como o compartilhamento de elétrons livres entre redes iônicas metálicas carregadas positivamente. A estrutura da ligação metálica é muito diferente da estrutura da ligação covalente e da ligação iônica. Na ligação metálica, os elétrons de valência deslocalizam os orbitais S e p dos átomos de metal que interagem. Isso é, eles não giram em torno de seus respectivos átomos metálicos, mas em torno dos núcleos carregados positivamente dos íons metálicos que interagem para formar o”mar” de elétrons. Então os elétrons se movem livremente no espaço entre os núcleos do átomo.
As chaves geralmente são formadas porque os átomos individuais são instáveis e a formação de ligações cria uma estrutura mais estável.
Todos os átomos possuem elétrons de valência: o número de grupos da tabela periódica informa quantos elétrons de valência têm um elemento ou metal específico (isso difere do elemento do bloco d, ou seja, o metal de transição).
Tipos de Ligação Metálica
Os metais são mais líquidos, mas não realmente ligados de forma cristalina. Ou seja. Alguns elétrons flutuantes ao redor dos átomos intimamente associados.Existem três estados da matéria.
Suas descobertas são descritas em um artigo publicado hoje na- arranjo ordenado regular de átomos/moléculas- necessário para a determinação da estrutura por meio de cristalografia de raios-X
Líquido-i.e. Entidades em movimento nas proximidades ( Posso estar errado, mas a maneira como me foi explicado é que “sólido” não é um estado da matéria. Os metais estão mais próximos dos líquidos. Alguns líquidos têm, ligações incompletas que estão em fluxo, ou seja,. Água Ligação metálica. Estou basicamente falando sobre pgf 1 deste artigo wiki. se você leu o artigo, fica complicado. Aparentemente, os metais, mesmo que sólidos, estão mais próximos dos líquidos do que os da Chrystal e, claro, os gases.
Gás- outras entidades dispersas, ou seja,. Moléculas/átomos
Importância da ligação metálica
Ligações metálicas permitir que os elementos conduzam eletricidade, eles podem ser moldados em formas e conduzem o calor facilmente. Este é o mais forte dos três principais títulos porque os elétrons são compartilhados em mais do que apenas as primeiras camadas. Quanto mais camadas envolvidas no compartilhamento de elétrons, quanto mais forte o ligação.
Ligação de hidrogênio
Um átomo de hidrogênio ligado covalentemente a um átomo fortemente eletronegativo pode estabelecer um ligação a outro átomo eletronegativo na mesma ou em moléculas diferentes. Essa ligação é chamada de ligação de hidrogênio. Para distinguir de uma ligação covalente normal, uma ligação de hidrogênio é representada por uma linha quebrada, por exemplo, X – H...Y onde X & Y são dois átomos eletronegativos. A força da ligação de hidrogênio é bastante baixa sobre 2-10 kcal mol-1 ou 8,4-42 kJ mol-1 em comparação com uma força de ligação covalente 50-100 kcal mol-1 ou 209 –419 kJmol-1
Condições para Ligação de Hidrogênio
O hidrogênio deve estar ligado a um elemento altamente eletronegativo.
O tamanho do elemento eletronegativo deve ser pequeno.
Esses dois critérios são preenchidos por F, O, e N na tabela periódica. Maior a eletronegatividade e menor o tamanho, mais forte é a ligação de hidrogênio que é evidente pela ordem relativa das energias das ligações de hidrogênio.
Tipos de ligação de hidrogênio
Ligação de hidrogênio intermolecular:Este tipo de ligação ocorre entre duas moléculas do mesmo tipo ou de tipos diferentes.. Por exemplo,
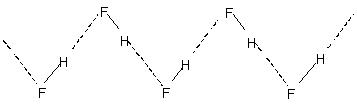
A ligação de hidrogênio intermolecular leva à associação molecular em líquidos como água, etc.. Assim, na água, apenas uma pequena porcentagem das moléculas de água parece não ter ligações de hidrogênio, mesmo a 90°C.. A quebra dessas ligações de hidrogênio em todo o líquido requer energia térmica apreciável. Isso é indicado nos pontos de ebulição relativamente mais altos de líquidos com ligações de hidrogênio. O fluoreto de hidrogênio cristalino consiste no polímero (HF)n. Este tem uma estrutura de cadeia em zig-zag envolvendo
H-bond.
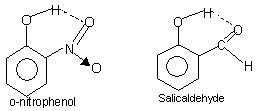
Ligação de hidrogênio intramolecular: Esse tipo de ligação ocorre entre átomos da mesma molécula presentes em sítios diferentes.. A ligação de hidrogênio intramolecular dá origem a uma estrutura de anel fechado para a qual o termo quelação é algumas vezes usado.. Exemplos são
o-nitrofenol, salicilaldeído.
Importância das ligações de hidrogênio em sistemas biológicos
As ligações de hidrogênio desempenham um papel vital nos sistemas fisiológicos. As proteínas contêm cadeias de aminoácidos. As unidades de aminoácidos estão dispostas em forma de espiral, como uma mola espiral esticada. (formando uma hélice). O grupo N-H de cada unidade de aminoácido e o quarto grupo C=O seguindo-o ao longo da cadeia, estabelece o N-H—O ligações de hidrogênio. Essas ligações são parcialmente responsáveis pela estabilidade da estrutura espiral. A estrutura de dupla hélice do DNA também consiste em duas fitas formando uma dupla hélice e são unidas uma à outra por meio de ligações de hidrogênio..
Efeito da ligação de hidrogênio
A ligação de hidrogênio tem efeitos muito pronunciados em certas propriedades das moléculas. Eles têm efeitos sobre
- Estado da substância
- Solubilidade da substância
- Ponto de ebulição
- Acidez de diferentes isômeros
Estes podem ser evidentes a partir dos seguintes exemplos.
Exemplo. H2O é um líquido à temperatura normal enquanto H2S é um gás, embora O e S pertençam ao mesmo grupo da tabela periódica.
Solução: H2O é capaz de formar ligações de hidrogênio intermoleculares. Isso é possível devido à alta eletronegatividade e ao pequeno tamanho do oxigênio. Devido à ligação H intermolecular, A associação molecular ocorre. Como resultado, o peso molecular efetivo aumenta e, portanto, o ponto de ebulição aumenta.. Então H2O é um líquido. Mas em H2S nenhuma ligação de hidrogênio é possível devido ao grande tamanho e menor eletronegatividade de S. Portanto, seu ponto de ebulição é igual ao de um H isolado2molécula S e, portanto, é um gás.
Exemplo.Álcool etílico (C2H5OH) tem um ponto de ebulição mais alto do que o éter dimetílico (CH3-SOMENTE O3) embora o peso molecular de ambos seja o mesmo.
Solução: Embora o álcool etílico e o éter dimetílico tenham o mesmo peso molecular, no álcool etílico o hidrogênio dos grupos O-H forma ligações de hidrogênio intermoleculares com o grupo OH em outra molécula. Mas no caso do éter o hidrogênio está ligado ao C não é tão eletronegativo para estimular o hidrogênio a partir da ligação de hidrogênio.
Devido à ligação H intermolecular, o álcool etílico permanece na forma associada e, portanto, ferve a uma temperatura mais alta em comparação com o éter dimetílico.
Crédito:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Deixe uma resposta
Você deve Conecte-se ou registro para adicionar uma nova resposta.