Разница между водородной связью и металлической связью
Что такое водородная связь?
Водородная связь - это форма межмолекулярной силы, которая возникает, когда водородные связи с сильно электроотрицательными элементами, такими как азот., кислород или фтор. В такой молекуле, отрицательно заряженный атом имеет частично отрицательный заряд, а водород имеет частично положительный заряд. Относительно заряженные части молекул сильно притягиваются друг к другу., как полюса магнитов.
Что такое металлическая облигация?
Металлическая связь возникает между атомами металла.. Крайние электроны атомов металла вытесняются или “делокализован.” На этом этапе делокализованные электроны не принадлежат какому-либо конкретному атому, а используются как общий “электронный пул.” Все положительно заряженные ядра атомов притягиваются к этим электронам., который скрепляет кусок металла.
Различия между металлической и водородной связью
Металлическая связь
Металлы отличаются ярким, блеск, высокая электрическая и теплопроводность, пластичность, пластичность и высокая прочность на разрыв. Металлический кристалл состоит из очень большого количества атомов, расположенных в правильном порядке.. Были предложены разные модели для объяснения природы металлического соединения двух наиболее важных модулей::
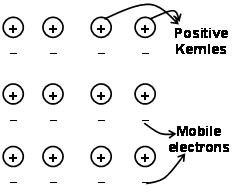
Силы, которые удерживают атомы вместе в металле в результате притяжения между положительными ионами и окружающими свободно подвижными электронами, известны как металлические связи..
Через электронное море, предшествовавшее квантовой механике, оно до сих пор удовлетворительно объясняет некоторые свойства металлов.. Например, электрическая и теплопроводность металлов., можно объяснить наличием подвижных электронов в металлах.. О приложении электронного поля, эти подвижные электроны проводят электричество через металлы от одного конца до другого.. так же, если одна часть металла нагревается, подвижные электроны в части металлов приобретают большое количество кинетической энергии. Быть свободным и мобильным, эти электроны быстро перемещаются по металлу и проводят тепло к другой части металла..
Условия для металлической связи
Связь металла можно описать как разделение свободных электронов между положительно заряженными ионными решетками металла.. Структура металла связи очень отличается от структуры ковалентной связи и ионной связи. В металлической связке, валентные электроны делокализуются s- и р-орбиталей из взаимодействующих атомов металла. То есть, они не вращаются вокруг своих соответствующих атомов металла, а вокруг положительно заряженные ядра ионов металлов, взаимодействующих с образованием”море” электронов. Затем электроны свободно перемещаются в пространстве между ядрами атома.
Ключи обычно образуются, потому что отдельные атомы нестабильны, а образование связей создает более стабильную структуру..
Все атомы имеют валентные электроны: количество групп периодической таблицы показывает, сколько валентных электронов имеет конкретный элемент или металл (это отличается от элемента d-блока, т.е. переходный металл).
Типы металлических облигаций
Металлы более жидкие, но не имеют кристаллической связи.. Т.е.. Некоторые парящие электроны вокруг тесно связанных атомов. Существуют три состояния вещества..
Кристалл- регулярный упорядоченный массив атомов / молекул- требуется для определения структуры с помощью рентгеновской кристаллографии
Жидкость-то есть. Движущиеся объекты в непосредственной близости ( Возможно, я ошибаюсь, но мне объяснили, что «твердое тело» не является состоянием материи.. Металлы ближе к жидким веществам. Некоторые жидкости имеют частичное, неполные связи, которые находятся в потоке, т.е.. Воды Металлическое соединение. Я просто говорю о pgf 1 этой статьи вики. если ты прочитал статью, это усложняется. Очевидно, металлы, даже если твердый ближе к жидкости, чем Кристал и, конечно газов.
газ- далее рассредоточенные объекты т.е.. Молекулы / атомы
Важность металлической связи
Металлические облигации позволить элементам проводить электричество, они могут быть сформированы в формы, и они проводят тепло легко. Это самый сильный из трех основные облигации потому что электроны делятся не только на первые оболочки. Чем больше оболочек, участвующих в электронах обмена, тем сильнее связь.
Водородная связь
Атом водорода, ковалентно связанный с сильно электроотрицательным атомом, может создавать сверхслабое присоединение к другому электроотрицательному атому в той же или разных молекулах. Это соединение называется водородной связью.. Чтобы отличить от обычной ковалентной связи, водородная связь представлена пунктирной линией, например X - H...Y, где X & Y - два электроотрицательных атома. Прочность водородной связи довольно низкая, примерно 2-10 ккал моль–1 или 8,4–42 кДж моль–1 по сравнению с прочностью ковалентной связи 50–100 ккал моль–1 или же 209 –419 кДж моль–1
Условия водородной связи
Водород должен быть связан с сильно электроотрицательным элементом..
Размер электроотрицательного элемента должен быть небольшим..
Этим двум критериям удовлетворяет F, О, и N в периодической таблице. Больше электроотрицательность и меньше размер, тем сильнее водородная связь, что видно из относительного порядка энергий водородных связей.
Типы водородной связи
Межмолекулярная водородная связь:Этот тип связи происходит между двумя молекулами одного или разных типов.. Например,
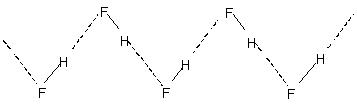
Межмолекулярная водородная связь приводит к молекулярной ассоциации в жидкостях, таких как вода и т. Д.. Таким образом, в воде только несколько процентов молекул воды не связаны водородными связями даже при 90 ° C.. Разрыв этих водородных связей во всей жидкости требует значительного количества тепловой энергии.. На это указывают относительно более высокие температуры кипения жидкостей с водородными связями.. Кристаллический фтороводород состоит из полимера (HF)N. Он имеет зигзагообразную цепную структуру, включающую
Водородная связь.
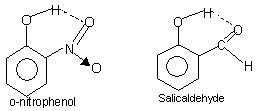
Внутримолекулярная водородная связь: Этот тип связи происходит между атомами одной и той же молекулы, находящимися в разных местах.. Внутримолекулярная водородная связь приводит к образованию замкнутой кольцевой структуры, для которой иногда используется термин хелатирование.. Примеры
о-нитрофенол, салициловый альдегид.
Важность водородной связи в биологических системах
Водородная связь играет важную роль в физиологических системах. Белки содержат цепочки аминокислот. Аминокислота блоки расположены в виде спирали несколько как растянутой спиральной пружины (образуя спираль). Н-Н группа каждой аминокислотной единицы, а четвертый C = O группы, следующие за ним по цепочке, устанавливает N-H—водородные связи O. Эти облигации частично ответственны за стабильность спиральной структуры. Структура двойной спирали ДНК также состоит из двух нитей, образующих двойную спираль, и соединенных друг с другом водородной связью..
Эффект водородной связи
Водородная связь очень сильно влияет на определенные свойства молекул.. Они повлияли на
- Состояние вещества
- Растворимость вещества
- Точка кипения
- Кислотность разных изомеров
Это видно из следующих примеров..
пример. ЧАС2O - жидкость при обычной температуре, а H2S - это газ, хотя и O, и S принадлежат к одной группе периодической таблицы..
Решение: ЧАС2O способен образовывать межмолекулярные водородные связи. Это возможно благодаря высокой электроотрицательности и небольшому размеру кислорода.. За счет межмолекулярной водородной связи, молекулярная ассоциация имеет место. В результате увеличивается эффективная молекулярная масса и, следовательно, температура кипения увеличивается.. Итак, H2O - жидкость. Но в H2S отсутствие водородных связей невозможно из-за большого размера и меньшей электроотрицательности S. Таким образом, его температура кипения равна температуре изолированного H2Молекула S и, следовательно, это газ.
пример.Этиловый спирт (С2ЧАС5ОЙ) имеет более высокую температуру кипения, чем диметиловый эфир (СН3-ТОЛЬКО О3) хотя молекулярная масса обоих одинакова.
Решение: Хотя этиловый спирт и диметиловый эфир имеют одинаковую молекулярную массу, но в этиловом спирте водород групп O-H образует межмолекулярную водородную связь с группой OH в другой молекуле.. Но в случае эфира водород, связанный с C, не настолько электроотрицателен, чтобы стимулировать водород от образования водородных связей..
За счет межмолекулярной водородной связи, этиловый спирт остается в связанной форме и поэтому кипит при более высокой температуре по сравнению с диметиловым эфиром.
кредит:HTTPS://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Оставьте ответ
Вы должны авторизоваться или же регистр добавить новый ответ.