हाइड्रोजन बांड और धातु बंधन के बीच अंतर
हाइड्रोजन बॉन्ड क्या है?
हाइड्रोजन बांड इंटरमॉलिक्युलर बल का एक रूप है जो तब होता है जब हाइड्रोजन बांड अत्यधिक विद्युतीय तत्वों जैसे नाइट्रोजन के साथ होता है, ऑक्सीजन या फ्लोरीन. ऐसे अणु में, ऋणात्मक रूप से आवेशित परमाणु का आंशिक रूप से ऋणात्मक आवेश होता है, और हाइड्रोजन का आंशिक रूप से धनात्मक आवेश है. अणुओं के अपेक्षाकृत आवेशित भाग एक दूसरे को दृढ़ता से आकर्षित करते हैं, चुम्बक के ध्रुवों की तरह.
धातुई बंधन क्या है?
धातु के परमाणुओं के बीच धात्विक बंधन होता है. धातु परमाणुओं के सबसे बाहरी इलेक्ट्रॉन विस्थापित हो जाते हैं या “स्थानीयकृत।” इस बिंदु पर निरूपित इलेक्ट्रॉन किसी विशेष परमाणु से संबंधित नहीं होते हैं, लेकिन एक सांप्रदायिक के रूप में साझा किए जाते हैं “इलेक्ट्रॉन पूल।” परमाणुओं के धनात्मक आवेश वाले नाभिक सभी इन इलेक्ट्रॉनों की ओर आकर्षित होते हैं, जो एक साथ धातु का एक टुकड़ा रखता है.
धात्विक और हाइड्रोजन बांड के बीच अंतर
धात्विक बंधन
धातुओं की विशेषता चमकीली होती है, आभा, उच्च विद्युत और तापीय चालकता, बढ़ने की योग्यता, लचीलापन और उच्च तन्यता ताकत. एक धात्विक क्रिस्टल में एक नियमित पैटर्न में व्यवस्थित बहुत बड़ी संख्या में परमाणु होते हैं. धातु बंधन की प्रकृति को समझाने के लिए विभिन्न मॉडल प्रस्तावित किए गए हैं दो सबसे महत्वपूर्ण मॉड्यूल इस प्रकार हैं:
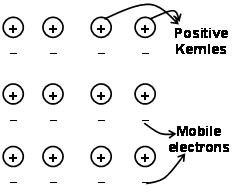
सकारात्मक आयनों और आसपास के मुक्त गतिशील इलेक्ट्रॉनों के बीच आकर्षण के परिणामस्वरूप धातु में परमाणुओं को एक साथ रखने वाले बलों को धातु बंधन के रूप में जाना जाता है.
इलेक्ट्रॉन समुद्र के माध्यम से क्वांटम यांत्रिकी से पहले यह अभी भी धातुओं के कुछ गुणों को संतोषजनक ढंग से समझाता है. उदाहरण के लिए धातुओं की विद्युत और तापीय चालकता, धातुओं में मोबाइल इलेक्ट्रॉनों की उपस्थिति द्वारा समझाया जा सकता है. इलेक्ट्रॉन क्षेत्र लगाने पर, ये मोबाइल इलेक्ट्रॉन एक सिरे से दूसरे सिरे तक सभी धातुओं में बिजली का संचालन करते हैं. उसी प्रकार, यदि धातु के एक भाग को गर्म किया जाए, धातुओं के हिस्से में मोबाइल इलेक्ट्रॉन बड़ी मात्रा में गतिज ऊर्जा प्राप्त करते हैं. स्वतंत्र और मोबाइल होना, ये इलेक्ट्रॉन पूरे धातु में तेजी से चलते हैं और धातु के दूसरे हिस्से में गर्मी का संचालन करते हैं.
धात्विक बांड के लिए शर्तें
धातु बंधन को सकारात्मक चार्ज धातु आयनिक जाली के बीच मुक्त इलेक्ट्रॉनों को साझा करने के रूप में वर्णित किया जा सकता है. धातु बंधन की संरचना सहसंयोजक बंधन और आयनिक बंधन की संरचना से बहुत अलग है. धातु बंधन में, संयोजकता इलेक्ट्रॉन परस्पर क्रिया करने वाले धातु परमाणुओं से S और p कक्षकों को स्थानीयकृत करते हैं. अर्थात्, वे अपने संबंधित धातु परमाणुओं के चारों ओर नहीं घूमते हैं, लेकिन परस्पर क्रिया करने वाले धातु आयनों के धनात्मक आवेशित नाभिक के आसपास”समुद्र” इलेक्ट्रॉनों का. तब इलेक्ट्रॉन परमाणु के नाभिकों के बीच के स्थान में स्वतंत्र रूप से गति करते हैं.
कुंजियाँ आमतौर पर इसलिए बनती हैं क्योंकि व्यक्तिगत परमाणु अस्थिर होते हैं और बंधन निर्माण एक अधिक स्थिर संरचना बनाता है.
सभी परमाणुओं में संयोजकता इलेक्ट्रॉन होते हैं: आवर्त सारणी के समूहों की संख्या आपको बताती है कि कितने वैलेंस इलेक्ट्रॉनों में एक विशिष्ट तत्व या धातु है (यह डी-ब्लॉक तत्व से अलग है, यानी संक्रमण धातु).
धातुई बांड के प्रकार
धातुएँ अधिक तरल होती हैं लेकिन वास्तव में क्रिस्टलीय तरीके से बंधी नहीं होती हैं. अर्थात. निकट से जुड़े परमाणुओं के आसपास कुछ तैरते हुए इलेक्ट्रॉन। पदार्थ की तीन अवस्थाएँ मौजूद होती हैं.
क्रिस्टल- परमाणुओं/अणुओं की नियमित क्रमित सरणी- एक्स-रे क्रिस्टलोग्राफी के माध्यम से संरचना निर्धारण के लिए आवश्यक
तरल-अर्थात. निकट में चलती संस्थाएं ( मैं गलत हो सकता हूं लेकिन जिस तरह से मुझे समझाया गया वह यह है कि "ठोस" पदार्थ की स्थिति नहीं है. धातुएँ लिगुइड्स के अधिक निकट होती हैं. कुछ तरल पदार्थों में आंशिक . होता है, अधूरे बंधन जो प्रवाह में हैं यानी. पानी धातु बंधन. Im मूल रूप से सिर्फ pgf . के बारे में बात कर रहा हूँ 1 इस विकि लेख के. यदि आप लेख पढ़ते हैं, यह जटिल हो जाता है. क्रिस्टल और निश्चित रूप से गैसों की तुलना में स्पष्ट रूप से धातुएं भले ही ठोस तरल पदार्थों के करीब हों.
गैस- आगे छितरी हुई इकाइयाँ अर्थात्. अणु/परमाणु
धात्विक बांड का महत्व
धात्विक बंधन तत्वों को बिजली का संचालन करने दें, वे आकार में बन सकते हैं और वे आसानी से गर्मी का संचालन करते हैं. यह तीनों में सबसे मजबूत है प्रमुख बंधन क्योंकि इलेक्ट्रॉन केवल पहले कोश से अधिक में साझा किए जाते हैं. इलेक्ट्रॉनों को साझा करने में जितने अधिक गोले शामिल होते हैं, उतना ही मजबूत गहरा संबंध.
हाइड्रोजन बंध
हाइड्रोजन का एक परमाणु सहसंयोजक रूप से एक मजबूत विद्युतीय परमाणु से जुड़ा हुआ है, एक अतिरिक्त कमजोर स्थापित कर सकता है समान या भिन्न अणुओं में किसी अन्य विद्युत ऋणात्मक परमाणु से लगाव. इस लगाव को हाइड्रोजन बांड कहा जाता है. एक सामान्य सहसंयोजक बंधन से अंतर करने के लिए, एक हाइड्रोजन बंधन को एक टूटी हुई रेखा द्वारा दर्शाया जाता है जैसे एक्स - एच…वाई जहां एक्स & Y दो विद्युत ऋणात्मक परमाणु हैं. हाइड्रोजन बांड की ताकत काफी कम है 2-10 किलो कैलोरी मोल-1 या 8.4–42 kJ mol-1 सहसंयोजक बंधन शक्ति की तुलना में 50-100 किलो कैलोरी मोल-1 या 209 -419 kJ mol-1
हाइड्रोजन बॉन्डिंग के लिए शर्तें
हाइड्रोजन को अत्यधिक विद्युत ऋणात्मक तत्व से जोड़ा जाना चाहिए.
विद्युत ऋणात्मक तत्व का आकार छोटा होना चाहिए.
ये दो मानदंड F . द्वारा पूरे किए जाते हैं, O, और एन आवर्त सारणी में. वैद्युतीयऋणात्मकता जितनी अधिक होगी और आकार छोटा होगा, हाइड्रोजन बंधन जितना मजबूत होता है, हाइड्रोजन बांड की ऊर्जा के सापेक्ष क्रम से स्पष्ट होता है.
हाइड्रोजन बॉन्डिंग के प्रकार
इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग:इस प्रकार का आबंध एक ही या भिन्न प्रकार के दो अणुओं के बीच होता है. उदाहरण के लिए,
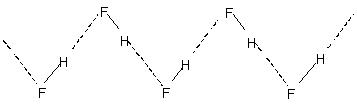
इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग से पानी आदि जैसे तरल पदार्थों में आणविक जुड़ाव होता है. इस प्रकार पानी में केवल कुछ प्रतिशत पानी के अणु 90°C . पर भी हाइड्रोजन बंधित नहीं प्रतीत होते हैं. पूरे तरल में उन हाइड्रोजन बांडों को तोड़ने के लिए प्रशंसनीय गर्मी ऊर्जा की आवश्यकता होती है. यह हाइड्रोजन बंधित द्रवों के अपेक्षाकृत उच्च क्वथनांक में इंगित किया गया है. क्रिस्टलीय हाइड्रोजन फ्लोराइड में बहुलक होते हैं (एचएफ)एन. इसमें एक ज़िग-ज़ैग श्रृंखला संरचना शामिल है
एच-बंधन.
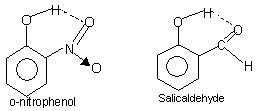
इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग: इस प्रकार का बंधन विभिन्न स्थलों पर मौजूद एक ही अणु के परमाणुओं के बीच होता है. इंट्रामॉलिक्युलर हाइड्रोजन बॉन्डिंग एक बंद रिंग संरचना को जन्म देती है जिसके लिए शब्द केलेशन कभी-कभी प्रयोग किया जाता है. उदाहरण हैं
ओ-नाइट्रोफेनोल, Salicylaldehyde.
जैविक प्रणालियों में हाइड्रोजन बंधन का महत्व
शारीरिक प्रणालियों में हाइड्रोजन बंधन एक महत्वपूर्ण भूमिका निभाता है. प्रोटीन में अमीनो एसिड की श्रृंखला होती है. अमीनो एसिड इकाइयों को एक सर्पिल रूप में व्यवस्थित किया जाता है जैसे कि एक फैला हुआ कुंडल वसंत (एक हेलिक्स बनाना). प्रत्येक अमीनो एसिड इकाई का NH समूह और श्रृंखला के साथ इसका अनुसरण करने वाला चौथा C=O समूह, N-H . की स्थापना करता है—हे हाइड्रोजन बांड. ये बंधन सर्पिल संरचना की स्थिरता के लिए आंशिक रूप से जिम्मेदार हैं. डीएनए की डबल हेलिक्स संरचना में भी दो स्ट्रैंड होते हैं जो एक डबल हेलिक्स बनाते हैं और हाइड्रोजन बॉन्ड के माध्यम से एक दूसरे से जुड़े होते हैं.
हाइड्रोजन बॉन्डिंग का प्रभाव
अणुओं के कुछ गुणों पर हाइड्रोजन बंधन का बहुत स्पष्ट प्रभाव पड़ा है. उन पर प्रभाव पड़ा है
- पदार्थ की अवस्था
- पदार्थ की घुलनशीलता
- क्वथनांक
- विभिन्न आइसोमर्स की अम्लता
ये निम्नलिखित उदाहरणों से स्पष्ट हो सकते हैं:.
उदाहरण. एच2O सामान्य ताप पर द्रव है जबकि H2S एक गैस है, हालांकि O और S दोनों आवर्त सारणी के एक ही समूह से संबंधित हैं.
समाधान: एच2O इंटरमॉलिक्युलर हाइड्रोजन बॉन्ड बनाने में सक्षम है. यह उच्च विद्युत ऋणात्मकता और ऑक्सीजन के छोटे आकार के कारण संभव है. इंटरमॉलिक्युलर एच-बॉन्डिंग के कारण, आणविक संघ होता है. परिणामस्वरूप प्रभावी आणविक भार बढ़ता है और इसलिए क्वथनांक बढ़ता है. तो ज2ओ एक तरल है. लेकिन H . में2S के बड़े आकार और कम वैद्युतीयऋणात्मकता के कारण कोई हाइड्रोजन बंधन संभव नहीं है. तो इसका क्वथनांक एक पृथक H . के क्वथनांक के बराबर होता है2एस अणु और इसलिए यह एक गैस है.
उदाहरण.एथिल अल्कोहोल (सी2एच5ओह) डाइमिथाइल ईथर की तुलना में अधिक क्वथनांक मिला है (चौधरी3-O-केवल3) हालांकि दोनों का आणविक भार समान है.
समाधान: हालांकि एथिल अल्कोहल और डाइमिथाइल ईथर का आणविक भार समान होता है लेकिन एथिल अल्कोहल में ओ-एच समूहों का हाइड्रोजन दूसरे अणु में ओएच समूह के साथ इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग बनाता है।. लेकिन ईथर के मामले में हाइड्रोजन सी से जुड़ा हुआ है, हाइड्रोजन को हाइड्रोजन बॉन्डिंग से प्रोत्साहित करने के लिए इतना इलेक्ट्रोनगेटिव नहीं है.
इंटरमॉलिक्युलर एच-बॉन्डिंग के कारण, एथिल अल्कोहल संबद्ध रूप में रहता है और इसलिए डाइमिथाइल ईथर की तुलना में उच्च तापमान पर उबलता है.
श्रेय:HTTPS के://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


एक उत्तर दें
आपको चाहिए लॉग इन करें या रजिस्टर करें एक नया उत्तर जोड़ने के लिए.