الفرق بين رابطة الهيدروجين والرابطة المعدنية
ما هو الهيدروجين بوند?
الهيدروجين السندات هو شكل من أشكال القوة بين الجزيئات التي تحدث عندما روابط هيدروجينية مع عناصر كهربية عالية مثل النيتروجين, الأكسجين أو الفلور. في مثل هذا الجزيء, الذرة سالبة الشحنة لها شحنة سالبة جزئيا, والهيدروجين لديه شحنة موجبة جزئيا. الأجزاء المشحونة نسبيا من جزيئات تجذب بقوة بعضها البعض, مثل قطبي المغناطيس.
ما هو لامع بوند?
يحدث السندات المعدني بين ذرات المعدن. الإلكترونات الخارجية للذرات المعدن تصبح طردت أو “ضلت موضعها الصحيح.” عند هذه النقطة إلكترون غير متمركز لا تنتمي إلى أي ذرة معينة ولكن يتم تقاسمها باعتبارها الطائفية “تجمع الإلكترون.” وإيجابا نوى المسؤول عن الذرات كلها لجذب هذه الإلكترونات, الذي يحمل قطعة من المعدن معا.
الاختلافات بين المعادن والسندات الهيدروجين
السندات معدنية
تتميز المعادن التي كتبها مشرق, بريق, الموصلية الكهربائية والحرارية العالية, تطويع, ليونة وقوة الشد العالية. يتكون الكريستال المعدني من عدد كبير جدا من ذرات مرتبة في نمط منتظم. وقد اقترحت نموذجا مختلفا لشرح طبيعة رابطة فلزية اثنين معظم وحدات مهمة هي كما يلي:
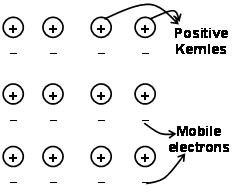
هي القوى التي تمسك الذرات معا في المعدن نتيجة التجاذب بين الأيونات الموجبة والإلكترونات المتحركة المحيطة بحرية تعرف باسم السندات المعدنية.
من خلال ميكانيكا الكم الإلكترون البحر سبقت أنه لا يزال يفسر مرض خصائص معينة من المعادن. الموصلية الكهربائية والحرارية للمعادن على سبيل المثال, ويمكن تفسير وجود الإلكترونات المتحركة في المعادن. على تطبيق حقل الإلكترون, توصل هذه الإلكترونات المتنقلة الكهرباء عبر المعادن من طرف إلى آخر. وبالمثل, إذا تم تسخين جزء واحد من المعدن, تكتسب الإلكترونات المتنقلة في جزء المعادن كمية كبيرة من الطاقة الحركية. أن تكون مجانيًا ومتحركًا, تتحرك هذه الإلكترونات بسرعة في جميع أنحاء المعدن وتوصيل الحرارة إلى الجزء الآخر من المعدن.
شروط السندات المعدنية
يمكن وصف الرابطة المعدنية بأنها مشاركة الإلكترونات الحرة بين المشابك المعدنية الأيونية موجبة الشحنة. هيكل السندات المعادن يختلف كثيرا عن هيكل الرابطة التساهمية والرابطة الأيونية. في السندات المعادن, إلكترونات التكافؤ delocalize S و ص المدارات من ذرات المعدن التفاعل. هذا هو, أنها لا تدور حول ذرات المعدن كل منها, ولكن في جميع أنحاء نواة موجبة الشحنة من ايونات المعادن التفاعل لتشكيل”بحر” من الإلكترونات. ثم الإلكترونات تتحرك بحرية في الفضاء بين نواة الذرة.
تتشكل المفاتيح عادةً لأن الذرات الفردية غير مستقرة ويؤدي تكوين الروابط إلى تكوين بنية أكثر استقرارًا.
جميع الذرات لها إلكترونات تكافؤ: يخبرك عدد مجموعات الجدول الدوري بعدد إلكترونات التكافؤ التي تحتوي على عنصر أو معدن معين (هذا يختلف عن عنصر d-block, أي المعدن الانتقالي).
أنواع الرابطة المعدنية
المعادن أكثر سيولة ولكنها غير مرتبطة حقًا بطريقة بلورية. بمعنى آخر. بعض الإلكترونات العائمة حول الذرات وثيقة الصلة ، وتوجد ثلاث حالات للمادة.
كريستال- مصفوفة منتظمة من الذرات / الجزيئات- مطلوب لتحديد الهيكل من خلال التصوير البلوري بالأشعة السينية
سائل-أي. تتحرك الكيانات على مقربة ( قد أكون مخطئًا ولكن الطريقة التي تم شرحها لي هي أن "الصلابة" ليست حالة من المادة. المعادن أقرب إلى الليغويدات. بعض السوائل لها جزئية, روابط غير مكتملة في حالة تغير مستمر ، أي. ماء رابطة فلزية. أنا أساسا أتحدث فقط عن pgf 1 من مقالة ويكي هذه. إذا كنت تقرأ المقال, تصبح معقدة. يبدو أن المعادن حتى لو كانت صلبة أقرب إلى السوائل من الكريستالية وبالطبع الغازات.
غاز- مزيد من الكيانات المشتتة ، أي. الجزيئات / الذرات
أهمية السندات المعدنية
السندات المعدنية تسمح للعناصر بتوصيل الكهرباء, يمكن تشكيلها في أشكال وتوصيل الحرارة بسهولة. هذا هو أقوى الثلاثة السندات الرئيسية لأن الإلكترونات مشتركة في أكثر من مجرد أصداف أولى. كلما زاد عدد الأصداف المشاركة في مشاركة الإلكترونات, أقوى كفالة.
رابطة الهيدروجين
يمكن لذرة الهيدروجين المرتبطة تساهميًا بذرة كهربية قوية أن تنشئ ضعفًا إضافيًا الارتباط بذرة كهربية أخرى في نفس الجزيئات أو جزيئات مختلفة. يسمى هذا الارتباط برابطة هيدروجينية. للتمييز عن الرابطة التساهمية العادية, يتم تمثيل الرابطة الهيدروجينية بخط مكسور مثل X - H...Y حيث X & ذرتان كهربائيتان. قوة الرابطة الهيدروجينية منخفضة للغاية 2-10 كيلو كالوري مول-1 أو 8.4-42 كيلوجول · مول-1 بالمقارنة مع قوة الرابطة التساهمية 50-100 كيلو كالوري مول-1 أو 209 –419 كيلوجول مول-1
شروط ارتباط الهيدروجين
يجب ربط الهيدروجين بعنصر كهرسلبي للغاية.
يجب أن يكون حجم العنصر الكهربائي صغيرًا.
يتم استيفاء هذين المعيارين من قبل F., ال, و N في الجدول الدوري. أكبر الكهربية وأصغر الحجم, الأقوى هي الرابطة الهيدروجينية التي تتضح من الترتيب النسبي لطاقات روابط الهيدروجين.
أنواع ارتباط الهيدروجين
الرابطة الهيدروجينية بين الجزيئات:يحدث هذا النوع من الترابط بين جزيئين من نفس النوع أو من أنواع مختلفة. فمثلا,
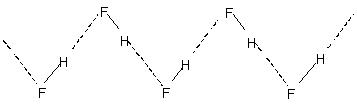
يؤدي الترابط الهيدروجيني بين الجزيئات إلى الارتباط الجزيئي في السوائل مثل الماء وما إلى ذلك. وهكذا في الماء ، يبدو أن نسبة قليلة فقط من جزيئات الماء غير مرتبطة بالهيدروجين حتى عند 90 درجة مئوية. يتطلب كسر هذه الروابط الهيدروجينية في جميع أنحاء السائل بأكمله طاقة حرارية ملحوظة. يشار إلى ذلك في نقاط الغليان الأعلى نسبيًا للسوائل المرتبطة بالهيدروجين. يتكون فلوريد الهيدروجين البلوري من البوليمر (HF)ن. هذا له هيكل سلسلة متعرج يتضمن
H- السندات.
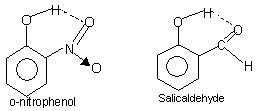
الرابطة الهيدروجينية داخل الجزيئية: يحدث هذا النوع من الترابط بين ذرات نفس الجزيء الموجودة في مواقع مختلفة. تؤدي الرابطة الهيدروجينية داخل الجزيئية إلى ظهور بنية حلقة مغلقة يستخدم مصطلح عملية إزالة معدن ثقيل في بعض الأحيان. الأمثلة
س-نيتروفينول, الساليسيلالدهيد.
أهمية ارتباط الهيدروجين في النظم البيولوجية
الهيدروجين الرابطة تلعب دورا حيويا في النظم الفسيولوجية. تحتوي البروتينات على سلاسل من الأحماض الأمينية. يتم ترتيب الأمينية وحدات الحامض في شكل حلزوني الى حد ما مثل لفائف الربيع امتدت (تشكيل الحلزون). مجموعة N-H من كل وحدة الأحماض الأمينية والرابع C = O مجموعة التالية على طول سلسلة, يحدد N-H—روابط هيدروجينية O. هذه السندات هي مسؤولة جزئيا عن استقرار الهيكل الحلزوني. يتكون الهيكل اللولبي المزدوج للحمض النووي أيضًا من خيطين يشكلان حلزونًا مزدوجًا ويتم ربطهما ببعضهما البعض من خلال رابطة هيدروجينية.
تأثير ارتباط الهيدروجين
كان للرابط الهيدروجيني تأثيرات واضحة جدًا على خصائص معينة للجزيئات. لديهم تأثيرات على
- حالة الجوهر
- ذوبان المادة
- نقطة الغليان
- حموضة الايزومرات المختلفة
يمكن أن يتضح ذلك من الأمثلة التالية.
مثال. H2O هو سائل عند درجة حرارة عادية بينما H2S هو غاز على الرغم من أن كلا من O و S ينتميان إلى نفس المجموعة من الجدول الدوري.
المحلول: H2O قادر على تكوين روابط هيدروجينية بين الجزيئات. هذا ممكن بسبب ارتفاع الطاقة الكهربية وصغر حجم الأكسجين. بسبب الترابط H بين الجزيئات, يحدث الارتباط الجزيئي. نتيجة لذلك ، يزداد الوزن الجزيئي الفعال وبالتالي تزداد نقطة الغليان. لذا ح2O سائل. لكن في H.2S لا توجد روابط هيدروجينية ممكنة بسبب الحجم الكبير وقلة الكهربية الكهربية لـ S.. لذا فهي نقطة غليان تساوي نقطة H المعزولة2جزيء S وبالتالي فهو غاز.
مثال.الكحول الإيثيلي (C2H5يا) نقطة غليان أعلى من ثنائي ميثيل الأثير (CH3-O-CH3) على الرغم من أن الوزن الجزيئي لكليهما متماثل.
المحلول: على الرغم من أن كحول الإيثيل وإيثر ثنائي ميثيل لهما نفس الوزن الجزيئي ، إلا أنه في كحول الإيثيل ، يشكل هيدروجين مجموعات O-H رابطة هيدروجينية بين الجزيئات مع مجموعة OH في جزيء آخر. ولكن في حالة الأثير ، فإن الهيدروجين المرتبط بـ C ليس كهربيًا جدًا لتشجيع الهيدروجين على الارتباط بالهيدروجين.
بسبب الترابط H بين الجزيئات, بقايا الكحول الإيثيلي في شكل المرتبطة، وبالتالي يغلي عند درجة حرارة أعلى مقارنة مع ثنائي ميثيل الاثير.
ائتمان:HTTPS://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


أضف إجابة
يجب عليك تسجيل الدخول او التسجيل لتستطيع اضافه إجابة .