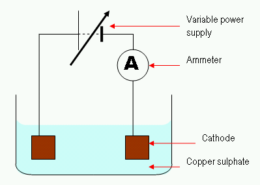
لماذا يتم تفريغ النحاس في التحليل الكهربائي للنحاس (II) محلول كبريتات?
في ال التحليل الكهربائي للنحاس (II) محلول كبريتات, يتم تفريغ أيونات النحاس بما يتناسب مع كمية النحاس (II) الأيونات المذابة في المحلول. تتم إزالة الأيونات المفرغة من المحلول من خلال مجموعة متنوعة من العمليات, بما في ذلك الامتصاص بواسطة المادة الصلبة أو الذوبان في الماء.
في النحاس (II) محلول كبريتات, ترتبط أيونات النحاس بالأنيونات (كبريتات) في رد فعل الأكسدة. رد الفعل العام هو:
2النحاس(الصورة) + 3H2O (ل) -> 2Cu2+ (عبد القدير) + 2ركن 4(عبد القدير)
يتم إطلاق أيونات النحاس نتيجة لاختزال أيونات SO4, مما يؤدي إلى تكوين غاز الهيدروجين.
تفريغ النحاس في التحليل الكهربائي للنحاس (II) محلول الكبريتات يرجع إلى الأسباب التالية:
1. تفكك CuSO 4 في الماء يحرر أيونات Cu2+. تتحد هذه الأيونات مع إلكترونات جزيئات الماء لتكوين H2O2. رد الفعل الثاني هذا هو طارد للحرارة ويطلق الحرارة, مما يسبب تفريغ النحاس.
2. تفكك CuSO 4 إلى Cu و SO 4 2- تُطلق الأيونات أيضًا Cu2+ وSO4+. تتحد هذه الأيونات مع إلكترونات جزيئات الماء لتكوين H2O وHSO4-. والنتيجة النهائية هي زيادة في تركيز هذه الأملاح وانخفاض في تركيز CuSO 4 .


أضف إجابة
يجب عليك تسجيل الدخول او التسجيل لتستطيع اضافه إجابة .