Definicja przeciwciał – Izotopy, Struktura, Funkcje, Zastosowania medyczne i wiele więcej
Przeciwciała są kręgosłupem układu odpornościowego w ludzkim ciele,w tym artykule przyjrzymy się dokładniej definicji przeciwciał,ich izotopy,medyczne zastosowanie przeciwciał i wiele więcej.
jakiś przeciwciało (z dala), znany również jako immunoglobulina (Ig),jest duży, Białko w kształcie litery Y, wytwarzane głównie przez komórki plazmatyczne, które jest wykorzystywane przez układ odpornościowy do neutralizacji patogenów, takich jak chorobotwórcze bakterie i wirusy.
Przeciwciało rozpoznaje unikalną cząsteczkę patogenu, zwany antygenem, poprzez fragment wiążący antygen (faj) regionu zmiennego, takiego jak SARS-CoV-2, wirus wywołujący COVID-19. Zwalczają infekcję, blokując części wirusa potrzebne do zakażenia komórki lub oznaczając je do zniszczenia przez układ odpornościowy.
Przeciwciała są wytwarzane przez komórki odpornościowe znane jako komórki B. Niewiarygodny zakres przeciwciał, które możemy wytworzyć, wynika z niewiarygodnego zakresu komórek B, które posiadamy. Kiedy jesteśmy zarażeni wirusem, mały zestaw komórek B rozpoznaje wirusa i, przez kilka tygodni, z pomocą innych komórek odpornościowych znanych jako limfocyty T, uczą się wytwarzać coraz silniejsze przeciwciała przeciwko wirusowi. Te limfocyty B dojrzewają i namnażają się w fabryki produkujące przeciwciała, znane jako komórki plazmatyczne.
Każda wskazówka “Y” przeciwciała zawiera paratop (analogiczny do zamka) który jest specyficzny dla jednego konkretnego epitopu (analogiczny do klucza) na antygenie, pozwalając tym dwóm strukturom połączyć się z precyzją.
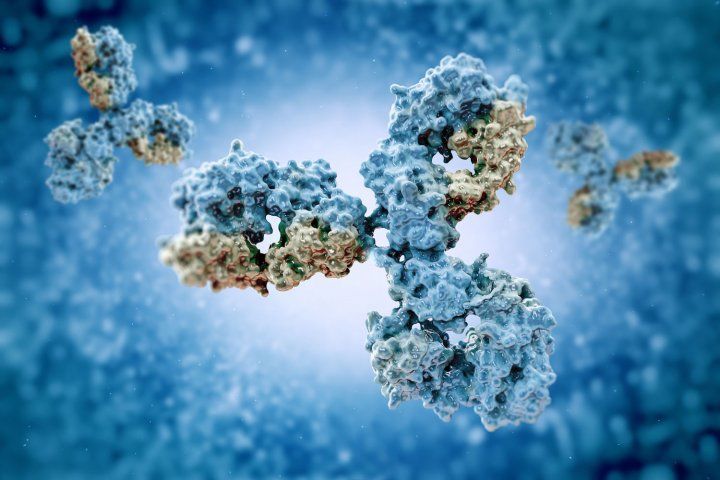
Przeciwciała w kształcie litery Y
Korzystanie z tego mechanizmu wiązania, przeciwciało może etykietka drobnoustrój lub zainfekowana komórka do ataku przez inne części układu odpornościowego, lub może bezpośrednio zneutralizować swój cel (na przykład, poprzez hamowanie części drobnoustroju, która jest niezbędna do jego inwazji i przetrwania).
W zależności od antygenu, wiązanie może utrudniać proces biologiczny powodujący chorobę lub może aktywować makrofagi do niszczenia obcej substancji.
Zdolność przeciwciała do komunikowania się z innymi składnikami układu odpornościowego odbywa się za pośrednictwem jego regionu Fc (znajdujące się u podstawy “Y”), który zawiera konserwatywne miejsce glikozylacji biorące udział w tych interakcjach. Wytwarzanie przeciwciał jest główną funkcją humoralnego układu odpornościowego.
Przeciwciała to glikoproteiny należące do nadrodziny immunoglobulin. Stanowią większość frakcji gamma globulin białek krwi. Zwykle składają się z podstawowych jednostek strukturalnych - każda z dwoma dużymi łańcuchami ciężkimi i dwoma małymi łańcuchami lekkimi.
Istnieje kilka różnych typów łańcuchów ciężkich przeciwciał, które definiują pięć różnych typów fragmentów zdolnych do krystalizacji (Fk) które mogą być przyłączone do fragmentów wiążących antygen.
Pięć różnych typów regionów Fc umożliwia pogrupowanie przeciwciał w pięć izotypy. Każdy region Fc określonego izotypu przeciwciała jest zdolny do wiązania się ze swoim specyficznym receptorem Fc (FcR), z wyjątkiem IgD, który zasadniczo jest BCR, umożliwiając w ten sposób kompleksowi antygen-przeciwciało pośredniczenie w różnych rolach w zależności od tego, który FcR wiąże.
Zdolność przeciwciała do wiązania się z odpowiadającym mu FcR jest dodatkowo modulowana przez strukturę glikanu(s) obecny w konserwatywnych miejscach w swoim regionie Fc.
Zdolność przeciwciał do wiązania się z FcR pomaga kierować odpowiednią odpowiedzią immunologiczną na każdy napotkany obiekt obcy. Na przykład, IgE odpowiada za reakcję alergiczną polegającą na degranulacji komórek tucznych i uwolnieniu histaminy.
Paratop Fab IgE wiąże się z antygenem alergicznym, na przykład cząsteczki roztoczy kurzu domowego, podczas gdy jego region Fc wiąże się z receptorem Fc ε. Interakcja alergen-IgE-FcRε pośredniczy w transdukcji sygnału alergicznego w celu wywołania stanów takich jak astma.
Chociaż ogólna struktura wszystkich przeciwciał jest bardzo podobna, mały region na końcu białka jest niezwykle zmienny, pozwalając milionom przeciwciał z nieco innymi strukturami końcówek, lub miejsca wiążące antygen, istnieć. Region ten jest znany jako region hiperzmienny.
Każdy z tych wariantów może wiązać się z innym antygenem. Ta ogromna różnorodność paratopów przeciwciał na fragmentach wiążących antygen umożliwia układowi odpornościowemu rozpoznawanie równie szerokiej gamy antygenów.
Duża i zróżnicowana populacja paratopu przeciwciała jest generowana przez przypadkowe zdarzenia rekombinacji zestawu segmentów genów, które kodują różne miejsca wiązania antygenu (lub paratopy), następnie losowe mutacje w tym obszarze genu przeciwciała, które tworzą dalszą różnorodność.
Ten proces rekombinacji, który wytwarza różnorodność paratopów klonalnych przeciwciał, nazywa się V(D)Rekombinacja J lub VJ. Paratop przeciwciała jest poligeniczny, składa się z trzech genów, V, D, i J. Każde locus paratopu jest również polimorficzne, tak, że podczas wytwarzania przeciwciał, jeden allel V, jeden z D, i wybrano jedno z J.
Te segmenty genów są następnie łączone ze sobą za pomocą losowej rekombinacji genetycznej w celu wytworzenia paratopu. Regiony, w których geny są losowo rekombinowane razem, to region hiperzmienny używany do rozpoznawania różnych antygenów na podstawie klonalnej.
Geny przeciwciał również reorganizują się w procesie zwanym przełączaniem klas, który zmienia jeden typ fragmentu Fc łańcucha ciężkiego na inny, tworzenie innego izotypu przeciwciała, który zachowuje specyficzny dla antygenu region zmienny. Pozwala to na wykorzystanie pojedynczego przeciwciała przez różne typy receptorów Fc, wyrażane w różnych częściach układu odpornościowego.
Izotopy Przeciwciał
Postać przeciwciała związaną z błoną można nazwać a immunoglobulina powierzchniowa (mowić) lub immunoglobulina błonowa (Ja).
Jest częścią Receptor komórek B (BCR), który pozwala komórce B wykryć obecność określonego antygenu w organizmie i wyzwala aktywację komórek B
.BCR składa się z związanych z powierzchnią przeciwciał IgD lub IgM i związanych z nimi heterodimerów Ig-α i Ig-β, które są zdolne do transdukcji sygnału. Typowa ludzka komórka B będzie miała 50,000 do 100,000 przeciwciała związane z jego powierzchnią.
Po związaniu antygenu, skupiają się w duże płaty, który może przekroczyć 1 mikrometr średnicy, na tratwach lipidowych, które izolują BCR od większości innych receptorów sygnalizacji komórkowej.
Te plastry mogą poprawiać skuteczność komórkowej odpowiedzi immunologicznej. U ludzi, powierzchnia komórki jest naga wokół receptorów komórek B przez kilkaset nanometrów,co dodatkowo izoluje BCR od konkurencyjnych wpływów.
Przeciwciała lub immunoglobuliny występują w różnych formach. Na podstawie różnic w sekwencjach aminokwasowych w regionie stałym łańcuchów ciężkich dzieli się je dalej na pięć klas. To są:
- IgG – zawierające łańcuch ciężki gamma
- IgM – zawierająca łańcuch ciężki mu
- IgA – zawierający łańcuch ciężki alfa
- IgD – zawierająca łańcuch ciężki delta
- IgE – zawierająca łańcuch ciężki epsilon
Każdy z nich jest nazwany z “Ig” przedrostek oznaczający immunoglobulinę (nazwa czasami używana zamiennie z przeciwciałem) i różnią się właściwościami biologicznymi, funkcjonalne lokalizacje i zdolność do radzenia sobie z różnymi antygenami, jak pokazano w tabeli.
Różne przyrostki izotypów przeciwciał oznaczają różne typy łańcuchów ciężkich, które zawiera przeciwciało, z każdą klasą łańcucha ciężkiego nazwaną alfabetycznie: a (alfa), c (gamma), d (delta), mi (epsilon), i μ (W). Powoduje to powstanie IgA, IgG, IgD, IgE, i IgM, odpowiednio.
Struktura
Przeciwciała są ciężkie (~150 kDa) globularne białka osocza. Wielkość cząsteczki przeciwciała wynosi ok 10 nm. Mają łańcuchy cukrowe (glikany) dodawane do konserwowanych reszt aminokwasowych.
Innymi słowy, przeciwciała są glikoproteiny.Przyłączone glikany są niezwykle ważne dla struktury i funkcji przeciwciała. Ekspresjonowane glikany mogą między innymi modulować powinowactwo przeciwciała do odpowiadającego mu FcR(s).

struktura przeciwciała
Podstawową jednostką funkcjonalną każdego przeciwciała jest immunoglobulina (Ig) monomer (zawierające tylko jedną jednostkę Ig); wydzielane przeciwciała mogą być również dimeryczne z dwiema jednostkami Ig, tak jak w przypadku IgA, tetrameryczny z czterema jednostkami Ig, takimi jak IgM ryb Teleost, lub pentameryczny z pięcioma jednostkami Ig, jak ssaki IgM.
Częściami zmiennymi przeciwciała są jego regiony V, a stałą częścią jest jego region C.
Domeny immunoglobulinowe
Monomerem Ig jest a “Y”-ukształtowana cząsteczka składająca się z czterech łańcuchów polipeptydowych; dwa identyczne ciężkie łańcuchy i dwa identyczne lekkie łańcuchy połączone wiązaniami dwusiarczkowymi.
Każdy łańcuch składa się z domen strukturalnych zwanych domenami immunoglobulinowymi. Domeny te zawierają około 70–110 aminokwasów i są podzielone na różne kategorie (na przykład, zmienna lub IgV, i stała lub IgC) w zależności od ich wielkości i funkcji.
Mają charakterystyczny fałd immunoglobulinowy, w którym dwie blaszki beta tworzą tzw “kanapka” kształt, utrzymywane razem przez interakcje między konserwatywnymi cysteinami i innymi naładowanymi aminokwasami.
Ciężki łańcuch
Istnieje pięć typów łańcuchów ciężkich Ig ssaków oznaczonych greckimi literami: a, d, mi, c, i μ. Rodzaj obecnego łańcucha ciężkiego określa klasa przeciwciała; te łańcuchy znajdują się w IgA, IgD, IgE, IgG, i przeciwciał IgM, odpowiednio.
Odrębne łańcuchy ciężkie różnią się wielkością i składem; α i γ zawierają ok 450 aminokwasy, podczas gdy μ i ε mają w przybliżeniu 550 aminokwasy.
Każdy łańcuch ciężki ma dwa regiony, ten region stały i region zmienny. Region stały jest identyczny we wszystkich przeciwciałach tego samego izotypu, ale różni się przeciwciałami różnych izotypów.
Ciężkie łańcuchy γ, α i δ mają region stały składający się z trzy tandem (w linii) Domeny Ig, oraz region zawiasowy dla dodatkowej elastyczności;łańcuchy ciężkie μ i ε mają region stały składający się z cztery domeny immunoglobulin.
Region zmienny łańcucha ciężkiego różni się przeciwciałami wytwarzanymi przez różne komórki B, ale jest taki sam dla wszystkich przeciwciał wytwarzanych przez pojedynczą komórkę B lub klon komórki B. Region zmienny każdego łańcucha ciężkiego wynosi w przybliżeniu 110 aminokwasów i składa się z pojedynczej domeny Ig.
Lekki łańcuch
U ssaków występują dwa rodzaje łańcuchów lekkich immunoglobulin, które nazywają się lambda (ja) i kappy (K).Łańcuch lekki ma dwie kolejne domeny: jedna domena stała i jedna domena zmienna.
Przybliżona długość łańcucha lekkiego to 211 do 217 aminokwasy. Każde przeciwciało zawiera dwa łańcuchy lekkie, które są zawsze identyczne; tylko jeden typ łańcucha lekkiego, κ lub λ, jest obecny na przeciwciało u ssaków. Inne rodzaje łańcuchów lekkich, jak jota (I) łańcuch, występują u innych kręgowców, takich jak rekiny (Chondrichthyes) i kościste ryby (Teleosty).
CDR, Fv, Regiony Fab i Fc
Różne części przeciwciała pełnią różne funkcje. konkretnie, ten “ramiona” (które są na ogół identyczne) zawierają miejsca, które mogą wiązać się z określonymi cząsteczkami, umożliwiające rozpoznanie określonych antygenów.
Ten region przeciwciała nazywa się faj (fragment, wiążący antygen) region. Składa się z jednej domeny stałej i jednej domeny zmiennej z każdego łańcucha ciężkiego i lekkiego przeciwciała.
Paratop na końcu aminowym monomeru przeciwciała jest kształtowany przez domeny zmienne z łańcuchów ciężkich i lekkich. Domena zmienna jest również określana jako FV region i jest najważniejszym regionem do wiązania się z antygenami.
Być konkretnym, zmienne pętle nici β, po trzy na światło (VL) i ciężki (Vh) łańcuchy są odpowiedzialne za wiązanie się z antygenem.
Te pętle są określane jako regiony determinujące komplementarność (CDR). Struktury tych CDR zostały pogrupowane i sklasyfikowane przez Chothię i in., a ostatnio przez North i in. oraz Nikoloudis i in..
W ramach teorii sieci immunologicznej, CDR są również nazywane idiotypami. Zgodnie z teorią sieci immunologicznej, adaptacyjny układ odpornościowy jest regulowany przez interakcje między idiotypami.
Podstawa Y odgrywa rolę w modulowaniu aktywności komórek odpornościowych. Region ten nazywa się Fk (Fragment, krystalizujący) region, i składa się z dwóch łańcuchów ciężkich, które składają się na dwie lub trzy domeny stałe, w zależności od klasy przeciwciała.
Zatem, region Fc zapewnia, że każde przeciwciało generuje odpowiednią odpowiedź immunologiczną na dany antygen, poprzez wiązanie się z określoną klasą receptorów Fc, i inne cząsteczki odpornościowe, takie jak białka dopełniacza.
Robiąc to, pośredniczy w różnych efektach fizjologicznych, w tym rozpoznawanie cząstek opsonizowanych (wiązanie z FcγR), liza komórek (wiążące się z dopełnieniem), i degranulacji komórek tucznych, bazofile, i eozynofile (wiązanie z FcεR).
W podsumowaniu, region Fab przeciwciała określa specyficzność antygenu, podczas gdy region Fc przeciwciała określa efekt klasowy przeciwciała.
Ponieważ tylko domeny stałe łańcuchów ciężkich tworzą region Fc przeciwciała, klasy łańcuchów ciężkich w przeciwciałach określają ich efekty klasowe. Możliwe klasy łańcuchów ciężkich w przeciwciałach obejmują alfa, gamma, delta, epsilon, i mu, i określają izotypy przeciwciała IgA, g, D, mi, oraz m, odpowiednio.
Oznacza to, że różne izotypy przeciwciał mają różne efekty klasowe ze względu na ich różne regiony Fc wiążące i aktywujące różne typy receptorów.
Możliwe efekty klasy przeciwciał obejmują: Opsonizacja, aglutynacja, hemoliza, aktywacja dopełniacza, degranulacja komórek tucznych, i neutralizacji (chociaż w tym efekcie klasy może pośredniczyć region Fab, a nie region Fc).
Oznacza to również, że efekty, w których pośredniczy Fab, są skierowane na drobnoustroje lub toksyny, podczas gdy efekty, w których pośredniczy Fc, są skierowane na komórki efektorowe lub cząsteczki efektorowe.
Funkcje
Główne kategorie działania przeciwciał obejmują następujące:
- Neutralizacja, w którym przeciwciała neutralizujące blokują części powierzchni komórki bakteryjnej lub wirionu, aby uczynić atak nieskutecznym
- Aglutynacja, w których przeciwciałach “skleić razem” obce komórki w grudki, które są atrakcyjnymi celami dla fagocytozy
- Opad atmosferyczny, w których przeciwciałach “skleić razem” antygeny rozpuszczalne w surowicy, zmuszając je do wytrącania się z roztworu w grudkach, które są atrakcyjnymi celami dla fagocytozy
- Aktywacja dopełniacza (fiksacja), w którym przeciwciała przyczepione do obcej komórki zachęcają dopełniacz do atakowania jej kompleksem atakującym błonę, co prowadzi do następującego:
- Liza obcej komórki
- Pobudzanie stanu zapalnego poprzez chemotaktyczne przyciąganie komórek zapalnych
Aktywowane limfocyty B różnicują się w komórki wytwarzające przeciwciała zwane komórkami plazmatycznymi, które wydzielają rozpuszczalne przeciwciała lub komórki pamięci, które przeżywają w organizmie przez wiele lat, aby umożliwić układowi odpornościowemu zapamiętanie antygenu i szybszą reakcję na przyszłe ekspozycje.
Na prenatalnym i noworodkowym etapie życia, obecność przeciwciał zapewnia bierna immunizacja matki. Wczesna produkcja przeciwciał endogennych jest różna dla różnych rodzajów przeciwciał, i zwykle pojawiają się w pierwszych latach życia.
Ponieważ przeciwciała występują swobodnie w krwioobiegu, mówi się, że są częścią humoralnego układu odpornościowego. Krążące przeciwciała są wytwarzane przez klonalne komórki B, które specyficznie reagują tylko na jeden antygen (przykładem jest fragment białka kapsydu wirusa).
Przeciwciała przyczyniają się do odporności na trzy sposoby: Wiążąc się z nimi, zapobiegają przedostawaniu się patogenów do komórek lub ich uszkodzeniu; stymulują usuwanie patogenów przez makrofagi i inne komórki poprzez powlekanie patogenu; i wyzwalają niszczenie patogenów poprzez stymulację innych odpowiedzi immunologicznych, takich jak szlak dopełniacza.
Przeciwciała będą również wyzwalać degranulację wazoaktywnej aminy, aby przyczynić się do odporności na niektóre typy antygenów (robaki, alergeny).
Aktywacja dopełniacza
Przeciwciała wiążące się z antygenami powierzchniowymi (na przykład, na bakterie) przyciągną pierwszy składnik kaskady dopełniacza swoim regionem Fc i zainicjują aktywację “klasyczny” układ dopełniacza.
Powoduje to zabicie bakterii na dwa sposoby. Po pierwsze, wiązanie cząsteczek przeciwciała i dopełniacza oznacza drobnoustroje do spożycia przez fagocyty w procesie zwanym opsonizacją; te fagocyty są przyciągane przez pewne cząsteczki dopełniacza generowane w kaskadzie dopełniacza.
Drugi, niektóre składniki układu dopełniacza tworzą kompleks atakujący błonę, aby pomóc przeciwciałom w bezpośrednim zabijaniu bakterii (bakterioliza).
Aktywacja komórek efektorowych
Zwalczanie patogenów, które replikują się poza komórkami, przeciwciała wiążą się z patogenami, łącząc je ze sobą, powodując ich aglutynację.
Ponieważ przeciwciało ma co najmniej dwa paratopy, może wiązać więcej niż jeden antygen przez wiązanie identycznych epitopów przenoszonych na powierzchniach tych antygenów.
Powlekając patogen, przeciwciała stymulują funkcje efektorowe przeciwko patogenowi w komórkach, które rozpoznają ich region Fc.
Te komórki, które rozpoznają powlekane patogeny, mają receptory Fc, który, jak sama nazwa wskazuje, oddziałują z regionem Fc IgA, IgG, i przeciwciał IgE.
Zaangażowanie określonego przeciwciała z receptorem Fc na określonej komórce wyzwala funkcję efektorową tej komórki; fagocyty będą fagocytować, komórki tuczne i neutrofile ulegną degranulacji, komórki NK będą uwalniać cytokiny i cząsteczki cytotoksyczne; co ostatecznie doprowadzi do zniszczenia atakującego drobnoustroju.
Aktywacja komórek NK przez przeciwciała inicjuje mechanizm cytotoksyczny znany jako cytotoksyczność komórkowa zależna od przeciwciał (ADCC) – proces ten może tłumaczyć skuteczność przeciwciał monoklonalnych stosowanych w biologicznych terapiach przeciwnowotworowych.
Receptory Fc są specyficzne dla izotypu, co zapewnia większą elastyczność układu odpornościowego, odwołując się tylko do odpowiednich mechanizmów odpornościowych dla różnych patogenów.
Naturalne przeciwciała
Produkują również ludzie i wyższe naczelne “naturalne przeciwciała” które były obecne w surowicy przed infekcją wirusową. Naturalne przeciwciała zostały zdefiniowane jako przeciwciała, które są wytwarzane bez wcześniejszej infekcji, szczepionka, ekspozycja na inny obcy antygen lub immunizacja bierna.
Przeciwciała te mogą aktywować klasyczny szlak dopełniacza, prowadząc do lizy otoczkowych cząstek wirusa na długo przed aktywacją adaptacyjnej odpowiedzi immunologicznej.
Wiele naturalnych przeciwciał jest skierowanych przeciwko disacharydowi galaktozie α(1,3)-galaktoza (α-Gal), który znajduje się jako końcowy cukier na glikozylowanych białkach powierzchniowych komórek, i wytwarzany w odpowiedzi na produkcję tego cukru przez bakterie znajdujące się w jelitach człowieka.
Uważa się, że odrzucenie ksenoprzeszczepionych narządów jest, częściowo, wynik wiązania naturalnych przeciwciał krążących w surowicy biorcy z antygenami α-Gal eksprymowanymi w tkance dawcy
Różnorodność immunoglobulin
Praktycznie wszystkie drobnoustroje mogą wywołać odpowiedź przeciwciał. Pomyślne rozpoznanie i wyeliminowanie wielu różnych rodzajów drobnoustrojów wymaga różnorodności przeciwciał; ich skład aminokwasowy jest różny, co pozwala im wchodzić w interakcje z wieloma różnymi antygenami.
Szacuje się, że człowiek generuje ok 10 miliardów różnych przeciwciał, każdy zdolny do wiązania odrębnego epitopu antygenu.
Chociaż u jednego osobnika generowany jest ogromny repertuar różnych przeciwciał, liczba genów dostępnych do wytworzenia tych białek jest ograniczona wielkością ludzkiego genomu.
Wyewoluowało kilka złożonych mechanizmów genetycznych, które umożliwiają komórkom B kręgowców generowanie zróżnicowanej puli przeciwciał ze stosunkowo niewielkiej liczby genów przeciwciał.
Zmienność domeny
Region chromosomalny, który koduje przeciwciało, jest duży i zawiera kilka odrębnych loci genów dla każdej domeny przeciwciała — region chromosomu zawierający geny łańcucha ciężkiego (IGH@) znajduje się na chromosomie 14, oraz loci zawierające geny łańcucha lekkiego lambda i kappa (IGL@ i IGK@) znajdują się na chromosomach 22 oraz 2 w ludziach.
Jedna z tych domen nazywana jest domeną zmienną, który jest obecny w każdym łańcuchu ciężkim i lekkim każdego przeciwciała, ale mogą różnić się różnymi przeciwciałami wytwarzanymi z różnych komórek B.
Różnice, między domenami zmiennymi, znajdują się w trzech pętlach zwanych regionami hiperzmiennymi (HV-1, HV-2 i HV-3) lub regiony determinujące komplementarność (CDR1, CDR2 i CDR3). CDR są obsługiwane w domenach zmiennych przez konserwatywne regiony zrębowe.
Locus łańcucha ciężkiego zawiera ok 65 różnych genów domeny zmiennej, z których wszystkie różnią się swoimi CDR. Połączenie tych genów z szeregiem genów dla innych domen przeciwciała generuje dużą kawalerię przeciwciał o wysokim stopniu zmienności.
Ta kombinacja nazywa się V(D)Rekombinacja J omówiona poniżej.
V(D)rekombinacja J
Rekombinacja somatyczna immunoglobulin, znany również jako V(D)rekombinacja J, obejmuje generowanie unikalnego regionu zmiennego immunoglobuliny.
Region zmienny każdego łańcucha ciężkiego lub lekkiego immunoglobuliny jest zakodowany w kilku fragmentach — zwanych segmentami genów (podgeny). Segmenty te nazywane są zmiennymi (V), różnorodność (D) i dołączam (J) segmenty.
V, Segmenty D i J znajdują się w łańcuchach ciężkich Ig, ale tylko segmenty V i J znajdują się w łańcuchach lekkich Ig. Wiele kopii V, Istnieją segmenty genów D i J, i są ułożone tandemowo w genomach ssaków. W szpiku kostnym, każda rozwijająca się komórka B złoży region zmienny immunoglobuliny przez losowy wybór i połączenie jednego V, jeden segment genu D i jeden J (lub jeden segment V i jeden J w łańcuchu lekkim).
Ponieważ istnieje wiele kopii każdego typu segmentu genu, i do wytworzenia każdego regionu zmiennego immunoglobuliny można zastosować różne kombinacje segmentów genów, proces ten generuje ogromną liczbę przeciwciał, każdy z innym paratopem, a tym samym różne specyficzności antygenowe.
Przegrupowanie kilku podgenów (tj. Rodzina V2) dla łańcucha lekkiego lambda immunoglobulina jest sprzężona z aktywacją mikroRNA miR-650, co dodatkowo wpływa na biologię komórek B.
Białka RAG odgrywają ważną rolę w V(D)Rekombinacja J polegająca na cięciu DNA w określonym regionie. Bez obecności tych białek, V(D)Rekombinacja J nie wystąpiła.
Po tym, jak komórka B wytworzy funkcjonalny gen immunoglobuliny podczas V(D)rekombinacja J, nie może wyrażać żadnego innego regionu zmiennego (proces znany jako wykluczenie alleli) zatem każda komórka B może wytwarzać przeciwciała zawierające tylko jeden rodzaj łańcucha zmiennego.
Hipermutacja somatyczna i dojrzewanie powinowactwa
Po aktywacji antygenem, Limfocyty B zaczynają się szybko rozmnażać. W tych szybko dzielących się komórkach, geny kodujące domeny zmienne łańcuchów ciężkiego i lekkiego przechodzą dużą szybkość mutacji punktowych, przez proces tzw hipermutacja somatyczna (SHM).
SHM powoduje około jedną zmianę nukleotydu na zmienny gen, na podział komórki. W konsekwencji, wszelkie potomne komórki B uzyskają niewielkie różnice aminokwasowe w domenach zmiennych ich łańcuchów przeciwciał.
Służy to zwiększeniu różnorodności puli przeciwciał i wpływa na powinowactwo przeciwciała do wiązania antygenu.
Niektóre mutacje punktowe spowodują wytwarzanie przeciwciał, które mają słabszą interakcję (niskie powinowactwo) z ich antygenem niż oryginalne przeciwciało, a niektóre mutacje będą generować przeciwciała o silniejszym oddziaływaniu (o wysokim powinowactwie).
Komórki B, które wykazują ekspresję przeciwciał o wysokim powinowactwie na swojej powierzchni, otrzymają silny sygnał przeżycia podczas interakcji z innymi komórkami, podczas gdy osoby z przeciwciałami o niskim powinowactwie nie będą, i umrze w wyniku apoptozy.
Zatem, Limfocyty B wykazujące ekspresję przeciwciał o wyższym powinowactwie do antygenu będą konkurować z komórkami o słabszym powinowactwie pod względem funkcji i przeżycia, umożliwiając wzrost średniego powinowactwa przeciwciał w czasie.
Proces wytwarzania przeciwciał o zwiększonym powinowactwie wiązania nazywa się dojrzewanie powinowactwa. Dojrzewanie powinowactwa zachodzi w dojrzałych komórkach B po V(D)rekombinacja J, i jest zależny od pomocy pomocniczych komórek T.
Przełączanie klas
Przełączanie izotypów lub klas jest procesem biologicznym zachodzącym po aktywacji limfocytów B, co umożliwia komórce wytwarzanie różnych klas przeciwciał (IgA, IgE, lub IgG).
Różne klasy przeciwciał, a tym samym funkcje efektorowe, są określone przez stałą (C) regiony łańcucha ciężkiego immunoglobuliny.
Początkowo, naiwne komórki B wyrażają tylko IgM i IgD na powierzchni komórki z identycznymi regionami wiążącymi antygen. Każdy izotyp jest przystosowany do innej funkcji; dlatego, po aktywacji, przeciwciało z IgG, IgA, lub funkcja efektorowa IgE może być wymagana do skutecznego wyeliminowania antygenu.
Przełączanie klas umożliwia różnym komórkom potomnym z tej samej aktywowanej komórki B wytwarzanie przeciwciał o różnych izotypach.
Tylko region stały łańcucha ciężkiego przeciwciała zmienia się podczas przełączania klas; regiony zmienne, a tym samym specyficzność antygenu, pozostają bez zmian.
Zatem potomstwo pojedynczej komórki B może wytwarzać przeciwciała, wszystkie specyficzne dla tego samego antygenu, ale ze zdolnością do wytwarzania funkcji efektorowej odpowiedniej dla każdej prowokacji antygenowej.
Przełączanie klas jest wyzwalane przez cytokiny; wygenerowany izotyp zależy od tego, które cytokiny są obecne w środowisku limfocytów B.
Przełączanie klas zachodzi w locus genu łańcucha ciężkiego przez mechanizm zwany rekombinacją przełączania klas (CSR). Mechanizm ten opiera się na konserwatywnych motywach nukleotydowych, Gra składa się z sześciu okresów Jeśli uczysz przyspieszonego uczenia się (S) regiony, znajduje się w DNA powyżej każdego genu regionu stałego (z wyjątkiem łańcucha δ).
Nić DNA jest rozrywana przez aktywność szeregu enzymów w dwóch wybranych regionach S.
Egzon domeny zmiennej jest ponownie łączony w procesie zwanym łączeniem niehomologicznych końców (NHEJ) do żądanego obszaru stałego (c, a lub e). W wyniku tego procesu powstaje gen immunoglobuliny, który koduje przeciwciało o innym izotypie.
Oznaczenia specyfiki
Można nazwać przeciwciałem monospecyficzny jeśli ma swoistość dla tego samego antygenu lub epitopu,lub dwuswoiste, jeśli mają powinowactwo do dwóch różnych antygenów lub dwóch różnych epitopów na tym samym antygenie.
Można nazwać grupę przeciwciał wielowartościowy (lub niespecyficzne) jeśli mają powinowactwo do różnych antygenów lub mikroorganizmów. Immunoglobulina dożylna, jeśli nie zaznaczono inaczej, składa się z różnych IgG (poliklonalne IgG). W przeciwieństwie, przeciwciała monoklonalne to identyczne przeciwciała wytwarzane przez pojedynczą komórkę B.
Asymetryczne przeciwciała
Przeciwciała heterodimeryczne, które są również asymetryczne i przeciwciała, pozwalają na większą elastyczność i nowe formaty dołączania różnych leków do ramion przeciwciała.
Jednym z ogólnych formatów przeciwciała heterodimerycznego jest “gałki-do-otworów” format. Ten format jest specyficzny dla części łańcucha ciężkiego regionu stałego w przeciwciałach.
ten “gałki” część została zaprojektowana przez zastąpienie małego aminokwasu większym. Pasuje do “otwór”, który jest konstruowany poprzez zastąpienie dużego aminokwasu mniejszym.
Co łączy “gałki” do “otwory” są wiązaniami dwusiarczkowymi między każdym łańcuchem. ten “gałki-do-otworów” kształt ułatwia cytotoksyczność komórkową zależną od przeciwciał.
Jednołańcuchowe fragmenty zmienne (scFv) są połączone z domeną zmienną łańcucha ciężkiego i lekkiego poprzez krótki peptyd łącznikowy. Łącznik jest bogaty w glicynę, co daje mu większą elastyczność, i seryna/treonina, co nadaje mu specyfiki.
Można połączyć ze sobą dwa różne fragmenty scFv, przez region zawiasowy, do domeny stałej łańcucha ciężkiego lub domeny stałej łańcucha lekkiego. Daje to przeciwciału dwuswoistość, pozwalając na specyficzność wiązania dwóch różnych antygenów.
ten “gałki-do-otworów” format zwiększa tworzenie heterodimerów, ale nie hamuje tworzenia homodimerów.
Dalsza poprawa funkcji przeciwciał heterodimerycznych, wielu naukowców szuka sztucznych konstrukcji.
Sztuczne przeciwciała to w dużej mierze różnorodne motywy białkowe, które wykorzystują strategię funkcjonalną cząsteczki przeciwciała, ale nie są ograniczone ograniczeniami strukturalnymi pętli i szkieletu naturalnego przeciwciała.
Możliwość kontrolowania kombinacyjnego projektu sekwencji i trójwymiarowej przestrzeni może wykraczać poza naturalny projekt i pozwalać na dołączanie różnych kombinacji leków do ramion.
Przeciwciała heterodimeryczne mają większy zakres kształtów, które mogą przybierać, a leki przymocowane do ramion nie muszą być takie same na każdym ramieniu, umożliwiając stosowanie różnych kombinacji leków w leczeniu raka.
Farmaceutyki są w stanie wytwarzać wysoce funkcjonalne bispecyficzne, a nawet wielogatunkowe, przeciwciała. Stopień, w jakim mogą funkcjonować, jest imponujący, biorąc pod uwagę, że taka zmiana kształtu z formy naturalnej powinna prowadzić do zmniejszenia funkcjonalności.
Zastosowania medyczne
Rozpoznanie choroby
Wykrywanie poszczególnych przeciwciał jest bardzo powszechną formą diagnostyki medycznej, a zastosowania, takie jak serologia, zależą od tych metod.
Na przykład, w testach biochemicznych do diagnozowania chorób,z krwi ocenia się miano przeciwciał skierowanych przeciwko wirusowi Epsteina-Barra lub boreliozie.
Jeśli te przeciwciała nie są obecne, albo osoba nie jest zakażona, albo doszło do zakażenia Filmy naukowe doktoranta są hitem na YouTube dawno temu, a komórki B wytwarzające te specyficzne przeciwciała naturalnie uległy rozkładowi.

diagnostyka medyczna przeciwciał
W immunologii klinicznej, poziomy poszczególnych klas immunoglobulin mierzy się za pomocą nefelometrii (lub turbidymetria) w celu scharakteryzowania profilu przeciwciał pacjenta. Podwyższenie poziomu różnych klas immunoglobulin jest czasami przydatne w określeniu przyczyny uszkodzenia wątroby u pacjentów, u których diagnoza jest niejasna.[1] Na przykład, podwyższone IgA wskazuje na alkoholową marskość wątroby, podwyższone IgM wskazuje na wirusowe zapalenie wątroby i pierwotną marskość żółciową wątroby, podczas gdy IgG jest podwyższone w wirusowym zapaleniu wątroby, autoimmunologiczne zapalenie wątroby i marskość wątroby.
Zaburzenia autoimmunologiczne często można przypisać przeciwciałom, które wiążą własne epitopy organizmu; wiele z nich można wykryć za pomocą badań krwi. Przeciwciała skierowane przeciwko antygenom powierzchniowym krwinek czerwonych w niedokrwistości hemolitycznej o podłożu immunologicznym są wykrywane za pomocą testu Coombsa. Test Coombsa jest również używany do wykrywania przeciwciał w przygotowaniu do transfuzji krwi, a także do wykrywania przeciwciał u kobiet w ciąży.
Praktycznie, Do diagnozowania chorób zakaźnych stosuje się kilka metod immunodiagnostycznych opartych na wykrywaniu kompleksu antygen-przeciwciało, na przykład ELISA, immunofluorescencja, Westernblot, immunodyfuzja, immunoelektroforeza, i magnetyczny test immunologiczny.
Przeciwciała skierowane przeciwko ludzkiej gonadotropinie kosmówkowej są używane w testach ciążowych dostępnych bez recepty.
Nowa chemia dioksaborolanów umożliwia radioaktywny fluor (18F) znakowanie przeciwciał, co pozwala na pozytronową tomografię emisyjną (ZWIERZAK DOMOWY) obrazowanie raka.
Terapia choroby
Ukierunkowana terapia przeciwciałami monoklonalnymi jest stosowana w leczeniu chorób takich jak reumatoidalne zapalenie stawów,Powoli postępująca demencja to rodzaj demencji, która zaczyna się jako okresowe zaburzenie wyższych funkcji mózgu i powoli przechodzi do etapu, w którym aktywność życia codziennego jest zaburzona,łuszczyca,i wiele form raka, w tym chłoniak nieziarniczy,rak jelita grubego, raka głowy i szyi oraz raka piersi.
Niektóre niedobory odporności, takie jak agammaglobulinemia sprzężona z chromosomem X i hipogammaglobulinemia, powodują częściowy lub całkowity brak przeciwciał. Choroby te są często leczone poprzez indukcję krótkotrwałej formy odporności zwanej odpornością bierną. Odporność bierną uzyskuje się poprzez przekazanie gotowych przeciwciał w postaci surowicy ludzkiej lub zwierzęcej, połączone immunoglobuliny lub przeciwciała monoklonalne, w osobę dotkniętą chorobą.
Terapia prenatalna
czynnik Rh, znany również jako antygen Rh D, jest antygenem znajdującym się na krwinkach czerwonych; osobniki Rh dodatnie (Rh+) mają ten antygen na krwinkach czerwonych i osoby Rh-ujemne (Rh–) nie rób.
Podczas normalnego porodu, uraz porodowy lub powikłania podczas ciąży, krew płodu może dostać się do organizmu matki.
W przypadku matki i dziecka o niezgodności Rh, wynikłe zmieszanie krwi może uwrażliwić Rh- matki do antygenu Rh na krwinkach dziecka Rh+, ułożenie reszty ciąży, i wszelkie kolejne ciąże, w grupie ryzyka choroby hemolitycznej noworodków.
Rho(D) przeciwciała immunoglobuliny są specyficzne dla ludzkiego antygenu RhD. Przeciwciała anty-RhD są podawane jako część schematu leczenia prenatalnego, aby zapobiec uczuleniu, które może wystąpić, gdy matka Rh-ujemna ma płód Rh-dodatni.
Leczenie matki przeciwciałami anty-RhD przed i bezpośrednio po urazie i porodzie powoduje zniszczenie antygenu Rh w organizmie matki z płodu.
Należy zauważyć, że dzieje się to, zanim antygen może stymulować matczyne komórki B “Zapamiętaj” antygen Rh poprzez generowanie komórek pamięci B.
W związku z tym, jej humoralny układ odpornościowy nie wytwarza przeciwciał anty-Rh, i nie będzie atakować antygenów Rh obecnych lub kolejnych dzieci.
Rho(D) Leczenie immunoglobuliną zapobiega uczuleniu, które może prowadzić do choroby Rh, ale nie zapobiega ani nie leczy samej choroby podstawowej.
Kredyt:
https://en.wikipedia.org/wiki/Antibody#Forms



Zostaw odpowiedź
Musisz Zaloguj sie lub Zarejestruj się dodać nową odpowiedź.