Różnica między wiązaniem wodorowym a wiązaniem metalicznym
Co to jest wiązanie wodorowe?
Wiązanie wodorowe to forma siły międzycząsteczkowej, która występuje, gdy wiązania wodorowe są silnie elektroujemnymi pierwiastkami, takimi jak azot, tlen lub fluor. W takiej cząsteczce, ujemnie naładowany atom ma częściowo ujemny ładunek, a wodór ma częściowo ładunek dodatni. Względnie naładowane części cząsteczek silnie się przyciągają, jak bieguny magnesów.
Co to jest wiązanie metaliczne?
Wiązanie metaliczne występuje między atomami metalu. Najbardziej zewnętrzne elektrony atomów metali zostają przemieszczone lub “zdelokalizowany.” W tym momencie zdelokalizowane elektrony nie należą do żadnego konkretnego atomu, ale są wspólne “pula elektronów.” Dodatnio naładowane jądra atomów są przyciągane przez te elektrony, który trzyma razem kawałek metalu.
Różnice między wiązaniami metalicznymi i wodorowymi
Metaliczny Bond
Metale charakteryzują się jasnym, połysk, wysoka przewodność elektryczna i cieplna, ciągliwość, ciągliwość i wysoka wytrzymałość na rozciąganie. Kryształ metaliczny składa się z bardzo dużej liczby atomów ułożonych w regularny wzór. Zaproponowano inny model wyjaśniający naturę wiązania metalicznego, dwa najważniejsze moduły są następujące:
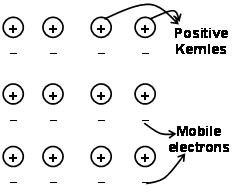
Siły, które utrzymują atomy razem w metalu w wyniku przyciągania się jonów dodatnich i otaczających swobodnie poruszających się elektronów, są znane jako wiązania metaliczne.
Poprzez morze elektronów poprzedzające mechanikę kwantową wciąż w zadowalający sposób wyjaśnia pewne właściwości metali. Na przykład przewodnictwo elektryczne i cieplne metali, można wytłumaczyć obecnością ruchomych elektronów w metalach. O zastosowaniu pola elektronowego, te ruchome elektrony przewodzą elektryczność w metalach od jednego końca do drugiego. podobnie, jeśli jedna część metalu jest podgrzewana, ruchome elektrony w części metali uzyskują dużą ilość energii kinetycznej. Będąc wolnym i mobilnym, elektrony te poruszają się szybko w metalu i przewodzą ciepło do drugiej części metalu.
Warunki spoiwa metalicznego
Wiązanie metaliczne można opisać jako dzielenie wolnych elektronów między dodatnio naładowanymi metalowymi siatkami jonowymi. Struktura wiązania metalu bardzo różni się od struktury wiązania kowalencyjnego i wiązania jonowego. W spoiwie metalowym, elektrony walencyjne przenoszą orbitale S i p z oddziałujących atomów metali. po egzekucji samego nakazu wiedziony przykładem, nie obracają się wokół odpowiednich atomów metali, ale wokół dodatnio naładowanych jąder oddziałujących jonów metali, tworząc”morze” elektronów. Wtedy elektrony poruszają się swobodnie w przestrzeni między jądrami atomu.
Klucze są zwykle tworzone, ponieważ poszczególne atomy są niestabilne, a tworzenie wiązań tworzy bardziej stabilną strukturę.
Wszystkie atomy mają elektrony walencyjne: liczba grup układu okresowego informuje, ile elektronów walencyjnych ma określony pierwiastek lub metal (różni się to od elementu d-block, czyli metal przejściowy).
Rodzaje wiązań metalicznych
Metale są bardziej płynne, ale tak naprawdę nie są związane w sposób krystaliczny. Tj. Niektóre unoszące się elektrony wokół blisko powiązanych atomów. Istnieją trzy stany skupienia materii.
Kryształ- regularny uporządkowany układ atomów/cząsteczek- wymagane do określenia struktury za pomocą chrystalografii rentgenowskiej
Płyn-tj. Poruszające się obiekty w bliskiej odległości ( Mogę się mylić, ale wyjaśniono mi, że „ciało stałe” nie jest stanem skupienia. Metale są bliżej cieczy. Niektóre płyny mają częściowe, niekompletne wiązania, które są w ruchu, tj. Woda Wiązanie metaliczne. Zasadniczo mówię tylko o PGF 1 tego artykułu na wiki. jeśli przeczytałeś artykuł, to się komplikuje. Najwyraźniej metale, nawet jeśli są stałe, są bliższe cieczom niż kryształy i oczywiście gazy.
Gaz- dalsze rozproszone podmioty tj. Cząsteczki/atomy
Znaczenie wiązań metalicznych
Wiązania metaliczne pozwalają elementom przewodzić prąd, można je formować w kształty i łatwo przewodzą ciepło. To najsilniejszy z całej trójki główne obligacje ponieważ elektrony są wspólne nie tylko na pierwszych powłokach. Im więcej powłok bierze udział w dzieleniu elektronów, tym silniejszy obligacja.
Wiązanie wodorowe
Atom wodoru związany kowalencyjnie z atomem silnie elektroujemnym może ustanowić dodatkowe słabe przyłączenie do innego elektroujemnego atomu w tej samej lub różnych cząsteczkach. To przyłączenie nazywa się wiązaniem wodorowym. Aby odróżnić od normalnego wiązania kowalencyjnego, wiązanie wodorowe jest reprezentowane przez linię przerywaną, np. X – H…Y gdzie X & Y to dwa atomy elektroujemne. Siła wiązania wodorowego jest dość niska 2-10 kcal mol–1 lub 8,4–42 kJ mol–1 w porównaniu z siłą wiązania kowalencyjnego 50–100 kcal mol–1 lub 209 -419 kJ razy–1
Warunki tworzenia wiązań wodorowych
Wodór powinien być połączony z pierwiastkiem o dużej elektroujemności.
Rozmiar elementu elektroujemnego musi być mały.
Te dwa kryteria spełnia F, TEN, i N w układzie okresowym. Większa elektroujemność i mniejszy rozmiar, tym silniejsze jest wiązanie wodorowe, co wynika ze względnego porządku energii wiązań wodorowych.
Rodzaje wiązań wodorowych
Międzycząsteczkowe wiązania wodorowe:Ten rodzaj wiązania zachodzi między dwiema cząsteczkami tego samego lub różnych typów. Na przykład,
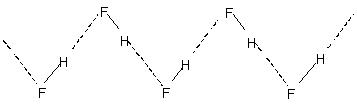
Międzycząsteczkowe wiązanie wodorowe prowadzi do asocjacji molekularnej w cieczach, takich jak woda itp. Tak więc w wodzie tylko kilka procent cząsteczek wody wydaje się nie mieć wiązań wodorowych nawet w temperaturze 90°C. Rozerwanie tych wiązań wodorowych w całej cieczy wymaga znacznej energii cieplnej. Wskazuje na to stosunkowo wyższa temperatura wrzenia cieczy związanych wiązaniami wodorowymi. Krystaliczny fluorowodór składa się z polimeru (HF)wnoszą również znaczący wkład w profil dydaktyczny i badawczy uczelni. Ma zygzakowatą strukturę łańcuchową
wiązanie H.
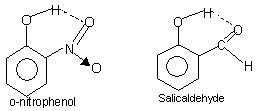
Wewnątrzcząsteczkowe wiązania wodorowe: Ten rodzaj wiązania występuje między atomami tej samej cząsteczki obecnymi w różnych miejscach. Wewnątrzcząsteczkowe wiązania wodorowe powodują powstanie zamkniętej struktury pierścieniowej, dla której czasami używa się terminu chelatowanie. Przykłady to
o-nitrofenol, aldehyd salicylowy.
Znaczenie wiązań wodorowych w systemach biologicznych
Wiązania wodorowe odgrywają istotną rolę w układach fizjologicznych. Białka zawierają łańcuchy aminokwasów. Jednostki aminokwasowe są ułożone spiralnie, podobnie jak rozciągnięta sprężyna śrubowa (tworząc helisę). Grupa N-H każdej jednostki aminokwasowej i czwarta grupa C=O po niej wzdłuż łańcucha, ustanawia N-H—O wiązania wodorowe. Wiązania te są częściowo odpowiedzialne za stabilność struktury spiralnej. Struktura podwójnej helisy DNA również składa się z dwóch nici tworzących podwójną helisę i połączonych ze sobą wiązaniem wodorowym.
Efekt wiązań wodorowych
Wiązania wodorowe mają bardzo wyraźny wpływ na niektóre właściwości cząsteczek. Mają wpływ na
- Stan substancji
- Rozpuszczalność substancji
- Temperatura wrzenia
- Kwasowość różnych izomerów
Można to stwierdzić na podstawie poniższych przykładów.
Przykład. h2O jest cieczą w zwykłej temperaturze, podczas gdy H2S jest gazem, chociaż zarówno O, jak i S należą do tej samej grupy układu okresowego.
Rozwiązanie: h2O jest zdolny do tworzenia międzycząsteczkowych wiązań wodorowych. Jest to możliwe dzięki dużej elektroujemności i małym rozmiarom tlenu. Ze względu na międzycząsteczkowe wiązanie H, zachodzi asocjacja molekularna. W rezultacie zwiększa się efektywna masa cząsteczkowa, a tym samym wzrasta temperatura wrzenia. więc H2O jest cieczą. Ale w H2S żadne wiązanie wodorowe nie jest możliwe ze względu na duży rozmiar i mniejszą elektroujemność S. Więc jego temperatura wrzenia jest równa temperaturze izolowanego H2cząsteczka S, a zatem jest gazem.
Przykład.Alkohol etylowy (C2h5OH) ma wyższą temperaturę wrzenia niż eter dimetylowy (CH3-O-TYLKO3) chociaż masa cząsteczkowa obu jest taka sama.
Rozwiązanie: Chociaż alkohol etylowy i eter dimetylowy mają taką samą masę cząsteczkową, ale w alkoholu etylowym wodór grup O-H tworzy międzycząsteczkowe wiązania wodorowe z grupą OH w innej cząsteczce. Ale w przypadku eteru wodór związany z C nie jest tak elektroujemny, aby zachęcać wodór do tworzenia wiązań wodorowych.
Ze względu na międzycząsteczkowe wiązanie H, alkohol etylowy pozostaje w postaci związanej i dlatego wrze w wyższej temperaturze w porównaniu z eterem dimetylowym.
Kredyt:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


Zostaw odpowiedź
Musisz Zaloguj sie lub Zarejestruj się dodać nową odpowiedź.