ความแตกต่างระหว่างพันธะไฮโดรเจนกับพันธะโลหะ
พันธะไฮโดรเจนคืออะไร?
พันธะไฮโดรเจนเป็นรูปแบบหนึ่งของแรงระหว่างโมเลกุลที่เกิดขึ้นเมื่อไฮโดรเจนจับกับองค์ประกอบที่มีอิเล็กโตรเนกาติเอตีสูง เช่น ไนโตรเจน, ออกซิเจนหรือฟลูออรีน. ในโมเลกุลดังกล่าว, อะตอมที่มีประจุลบมีประจุลบบางส่วน, และไฮโดรเจนมีประจุบวกบางส่วน. ส่วนที่มีประจุค่อนข้างจะดึงดูดกันอย่างมาก, เหมือนเสาแม่เหล็ก.
พันธะโลหะคืออะไร?
พันธะโลหะเกิดขึ้นระหว่างอะตอมของโลหะ. อิเล็กตรอนชั้นนอกสุดของอะตอมโลหะหลุดออกหรือ “โลคัลไลซ์” ณ จุดนี้อิเล็กตรอนที่แยกตัวออกจากกันไม่ได้เป็นของอะตอมใด ๆ แต่ถูกแบ่งใช้ร่วมกันเป็นชุมชน “สระอิเล็กตรอน” นิวเคลียสที่มีประจุบวกของอะตอมล้วนดึงดูดอิเล็กตรอนเหล่านี้, ที่ยึดแผ่นโลหะไว้ด้วยกัน.
ความแตกต่างระหว่างพันธะโลหะและไฮโดรเจน
พันธบัตรโลหะ
โลหะมีลักษณะสดใส, ความเป็นเงา, การนำไฟฟ้าและความร้อนสูง, ความอ่อนไหว, ความเหนียวและความต้านทานแรงดึงสูง. คริสตัลเมทัลลิกประกอบด้วยอะตอมจำนวนมากที่จัดเรียงในรูปแบบปกติ. มีการเสนอแบบต่างๆ เพื่ออธิบายลักษณะการยึดติดของโลหะ โดยมี 2 โมดูลที่สำคัญที่สุดดังนี้:
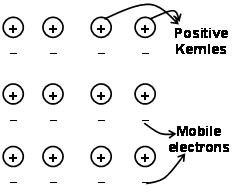
แรงที่ยึดอะตอมไว้ด้วยกันในโลหะอันเป็นผลมาจากแรงดึงดูดระหว่างไอออนบวกกับอิเล็กตรอนเคลื่อนที่อิสระที่อยู่รอบๆ เรียกว่าพันธะโลหะ.
กลศาสตร์ควอนตัมก่อนทะเลอิเล็กตรอน มันยังคงอธิบายคุณสมบัติบางอย่างของโลหะได้อย่างน่าพอใจ. ค่าการนำไฟฟ้าและความร้อนของโลหะ เช่น, สามารถอธิบายได้จากการมีอยู่ของอิเล็กตรอนเคลื่อนที่ในโลหะ. ในการใช้สนามอิเล็กตรอน, อิเล็กตรอนเคลื่อนที่เหล่านี้จะนำไฟฟ้าไปทั่วโลหะจากปลายด้านหนึ่งไปยังอีกด้านหนึ่ง. ซึ่งเชื่อว่าจะเป็นประโยชน์ต่อการส่งมอบยาที่ต้องฉีดต่อไปในระยะยาว, ถ้าส่วนใดส่วนหนึ่งของโลหะถูกทำให้ร้อน, อิเล็กตรอนเคลื่อนที่ในส่วนของโลหะจะได้รับพลังงานจลน์จำนวนมาก. เป็นอิสระและเคลื่อนที่, อิเล็กตรอนเหล่านี้เคลื่อนที่อย่างรวดเร็วทั่วโลหะและนำความร้อนไปยังส่วนอื่น ๆ ของโลหะ.
เงื่อนไขสำหรับพันธบัตรโลหะ
พันธะโลหะสามารถอธิบายได้ว่าเป็นการแบ่งปันอิเล็กตรอนอิสระระหว่างโครงตาข่ายไอออนของโลหะที่มีประจุบวก. โครงสร้างของพันธะโลหะแตกต่างจากโครงสร้างของพันธะโควาเลนต์และพันธะไอออนิกมาก. ในพันธะโลหะ, วาเลนซ์อิเล็กตรอนแยกตำแหน่ง S และ p ออร์บิทัลออกจากอะตอมโลหะที่มีปฏิสัมพันธ์. นั่นคือ, พวกมันไม่หมุนรอบอะตอมของโลหะ, แต่รอบๆ นิวเคลียสที่มีประจุบวกของไอออนโลหะที่มีปฏิสัมพันธ์กันเพื่อสร้าง”ทะเล” ของอิเล็กตรอน. จากนั้นอิเล็กตรอนจะเคลื่อนที่อย่างอิสระในช่องว่างระหว่างนิวเคลียสของอะตอม.
กุญแจมักจะก่อตัวขึ้นเนื่องจากอะตอมแต่ละอะตอมไม่เสถียรและการก่อตัวของพันธะจะสร้างโครงสร้างที่เสถียรมากขึ้น.
อะตอมทั้งหมดมีเวเลนซ์อิเล็กตรอน: จำนวนกลุ่มของตารางธาตุจะบอกจำนวนอิเล็กตรอนที่มีธาตุหรือโลหะเฉพาะ (ซึ่งแตกต่างจากองค์ประกอบ d-block, เช่น โลหะทรานซิชัน).
ประเภทของพันธบัตรโลหะ
โลหะมีของเหลวมากกว่าแต่ไม่ได้จับกันเป็นผลึกจริงๆ. เช่น. อิเล็กตรอนบางตัวที่ลอยอยู่รอบๆ อะตอมที่เกี่ยวข้องกันอย่างใกล้ชิด มีสถานะสสารอยู่ 3 สถานะ.
เหล่านี้เป็นหัวข้อที่ครอบคลุมในหลักสูตร- อาร์เรย์ของอะตอม / โมเลกุลที่ได้รับคำสั่งปกติ- ที่จำเป็นสำหรับการกำหนดโครงสร้างผ่านผลึกเอ็กซ์เรย์
ของเหลว-เช่น. การย้ายหน่วยงานในบริเวณใกล้เคียง ( ฉันอาจจะผิด แต่วิธีที่อธิบายกับฉันคือ "ของแข็ง" ไม่ใช่สถานะของสสาร. โลหะอยู่ใกล้กับของเหลวมากขึ้น. ของเหลวบางชนิดมีบางส่วน, พันธะที่ไม่สมบูรณ์ที่อยู่ในฟลักซ์เช่น. น้ำ พันธะโลหะ. ฉันแค่พูดถึง pgf 1 ของบทความวิกินี้. ถ้าคุณอ่านบทความ, มันซับซ้อน. เห็นได้ชัดว่าโลหะแม้ว่าของแข็งจะอยู่ใกล้กับของเหลวมากกว่าของคริสตัลและแน่นอนก๊าซ.
แก๊ส- เอนทิตีที่กระจัดกระจายเพิ่มเติม เช่น. โมเลกุล/อะตอม
ความสำคัญของพันธะโลหะ
พันธะโลหะ ให้ธาตุนำไฟฟ้าได้, สามารถขึ้นรูปเป็นรูปทรงและนำความร้อนได้ง่าย. นี่คือความแข็งแกร่งที่สุดในสาม พันธบัตรที่สำคัญ เพราะอิเล็กตรอนมีร่วมกันมากกว่าเปลือกแรก. เปลือกที่เกี่ยวข้องกับการแบ่งปันอิเล็กตรอนมากขึ้น, ยิ่งแข็งแกร่ง พันธบัตร.
พันธะไฮโดรเจน
อะตอมของไฮโดรเจนที่เชื่อมอย่างโควาเลนต์กับอะตอมที่มีอิเล็กโตรเนกาทีฟอย่างแรงสามารถสร้างจุดอ่อนพิเศษได้ การยึดติดกับอะตอมอิเล็กโตรเนกาติตีอื่นในโมเลกุลเดียวกันหรือต่างกัน. สิ่งที่แนบมานี้เรียกว่าพันธะไฮโดรเจน. เพื่อแยกความแตกต่างจากพันธะโควาเลนต์ปกติ, พันธะไฮโดรเจนแทนด้วยเส้นหัก เช่น X – H…Y ที่ไหน X & Y เป็นอะตอมอิเลคโตรเนกาติตีสองอะตอม. ความแรงของพันธะไฮโดรเจนค่อนข้างต่ำเกี่ยวกับ 2-10 แคลอรี่ โมล–1 หรือ 8.4–42 kJ โมล–1 เมื่อเทียบกับความแข็งแรงพันธะโควาเลนต์ 50-100 กิโลแคลอรี โมล–1 หรือ 209 –419 kJ โมล–1
เงื่อนไขสำหรับพันธะไฮโดรเจน
ไฮโดรเจนควรเชื่อมโยงกับองค์ประกอบที่มีอิเล็กโตรเนกาติเอตสูง.
ขนาดขององค์ประกอบอิเล็กโตรเนกาทีฟต้องเล็ก.
F . ปฏิบัติตามเกณฑ์ทั้งสองนี้, เธ, และ N ในตารางธาตุ. อิเล็กโตรเนกาติวีตี้ยิ่งใหญ่และมีขนาดเล็กลง, พันธะไฮโดรเจนที่แรงกว่าซึ่งเห็นได้จากลำดับสัมพัทธ์ของพลังงานของพันธะไฮโดรเจน.
ประเภทของพันธะไฮโดรเจน
พันธะไฮโดรเจนระหว่างโมเลกุล:พันธะประเภทนี้เกิดขึ้นระหว่างสองโมเลกุลที่เป็นชนิดเดียวกันหรือต่างกัน. ตัวอย่างเช่น,
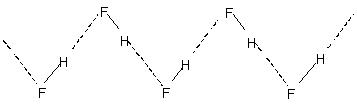
พันธะไฮโดรเจนระหว่างโมเลกุลทำให้เกิดการรวมตัวของโมเลกุลในของเหลวเช่นน้ำเป็นต้น. ดังนั้นในน้ำ โมเลกุลของน้ำเพียงไม่กี่เปอร์เซ็นต์เท่านั้นที่จะไม่ถูกพันธะไฮโดรเจนแม้ที่อุณหภูมิ 90°C. การสลายตัวของพันธะไฮโดรเจนทั่วทั้งของเหลวนั้นต้องการพลังงานความร้อนที่ประเมินค่าได้. สิ่งนี้แสดงให้เห็นในจุดเดือดที่ค่อนข้างสูงของของเหลวที่ถูกผูกมัดด้วยไฮโดรเจน. ผลึกไฮโดรเจนฟลูออไรด์ประกอบด้วยพอลิเมอร์ (HF)ทำไม Tundra Biome จึงเป็น Biome ที่หนาวที่สุดในโลก. มีโครงสร้างโซ่ซิกแซกที่เกี่ยวข้องกับ
H-บอนด์.
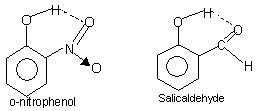
พันธะไฮโดรเจนภายในโมเลกุล: พันธะประเภทนี้เกิดขึ้นระหว่างอะตอมของโมเลกุลเดียวกันที่อยู่บนตำแหน่งต่างกัน. พันธะไฮโดรเจนภายในโมเลกุลทำให้เกิดโครงสร้างวงแหวนปิด ซึ่งบางครั้งใช้คำว่าคีเลชั่น. ตัวอย่างคือ
โอ-ไนโตรฟีนอล, ซาลิไซอัลดีไฮด์.
ความสำคัญของพันธะไฮโดรเจนในระบบชีวภาพ
พันธะไฮโดรเจนมีบทบาทสำคัญในระบบสรีรวิทยา. โปรตีนประกอบด้วยสายโซ่ของกรดอะมิโน. หน่วยของกรดอะมิโนถูกจัดเรียงในลักษณะเกลียวคล้ายกับคอยล์สปริงแบบยืดออก (เกิดเป็นเกลียว). หมู่ N-H ของแต่ละหน่วยของกรดอะมิโนและกลุ่ม C=O ที่สี่ที่ตามมาตามสายโซ่, ก่อตั้ง N–H—O พันธะไฮโดรเจน. พันธะเหล่านี้มีส่วนรับผิดชอบต่อความเสถียรของโครงสร้างเกลียว. โครงสร้างเกลียวคู่ของ DNA ยังประกอบด้วยสองสายที่ก่อตัวเป็นเกลียวคู่และเชื่อมต่อกันผ่านพันธะไฮโดรเจน.
ผลของพันธะไฮโดรเจน
พันธะไฮโดรเจนมีผลเด่นชัดมากต่อคุณสมบัติบางอย่างของโมเลกุล. พวกเขามีผลกระทบต่อ
- สถานะของสาร
- ความสามารถในการละลายของสาร
- จุดเดือด
- ความเป็นกรดของไอโซเมอร์ต่างๆ
สิ่งเหล่านี้สามารถเห็นได้จากตัวอย่างต่อไปนี้.
ตัวอย่าง. ชม2O เป็นของเหลวที่อุณหภูมิปกติในขณะที่H2S เป็นก๊าซแม้ว่าทั้ง O และ S จะอยู่ในกลุ่มเดียวกันของตารางธาตุ.
วิธีการแก้: ชม2O สามารถสร้างพันธะไฮโดรเจนระหว่างโมเลกุลได้. เป็นไปได้เนื่องจากมีอิเล็กโตรเนกาติวีตี้สูงและออกซิเจนขนาดเล็ก. เนื่องจากพันธะ H ระหว่างโมเลกุล, ความสัมพันธ์ระดับโมเลกุลเกิดขึ้น. เป็นผลให้น้ำหนักโมเลกุลที่มีประสิทธิภาพเพิ่มขึ้นและด้วยเหตุนี้จุดเดือดจึงเพิ่มขึ้น. โซ โฮ2O เป็นของเหลว. แต่ใน H2S ไม่มีพันธะไฮโดรเจนเกิดขึ้นได้เนื่องจากขนาดใหญ่และมีค่าอิเล็กโตรเนกาติวีตี้น้อยกว่าของ S. ดังนั้นจุดเดือดจึงเท่ากับของ H . ที่แยกออกมา2โมเลกุล S ดังนั้นจึงเป็นแก๊ส.
ตัวอย่าง.เอทิลแอลกอฮอล์ (ค2ชม5โอ้) มีจุดเดือดสูงกว่าไดเมทิลอีเทอร์ (CH3-O-ONLY3) แม้ว่าน้ำหนักโมเลกุลของทั้งสองจะเท่ากัน.
วิธีการแก้: แม้ว่าเอทิลแอลกอฮอล์และไดเมทิลอีเทอร์จะมีน้ำหนักโมเลกุลเท่ากัน แต่ในเอทิลแอลกอฮอล์ ไฮโดรเจนของกลุ่ม OH จะสร้างพันธะไฮโดรเจนระหว่างโมเลกุลกับกลุ่ม OH ในโมเลกุลอื่น. แต่ในกรณีของอีเทอร์ ไฮโดรเจนที่เชื่อมกับ C จะไม่ทำให้เกิดอิเลคโตรเนกาติเอตีจนกระตุ้นไฮโดรเจนจากพันธะไฮโดรเจน.
เนื่องจากพันธะ H ระหว่างโมเลกุล, เอทิลแอลกอฮอล์ยังคงอยู่ในรูปแบบที่เกี่ยวข้องจึงเดือดที่อุณหภูมิสูงกว่าเมื่อเปรียบเทียบกับไดเมทิลอีเทอร์.
เครดิต:https://www.askiitians.com/iit-jee-chemical-bonding/metallic-and-hydrogen-bonding.html


ทิ้งคำตอบไว้
คุณต้อง เข้าสู่ระบบ หรือ ลงทะเบียน เพื่อเพิ่มคำตอบใหม่.